
- •Практическое занятие № 1, 2. Самореплицирующиеся молекулы. Естественный отбор самореплицирующихся молекул.
- •II. Третичная структура днк. Cверхспирализация днк.
- •Доказательства генетической роли нуклеиновых кислот
- •Принципиальная организация днк. Модель днк Уотсона и Крика
- •Хугстеновское спаривание – основа формирования триплексов днк. Н-днк.
- •Явление суперспирализации днк.
- •Регуляция топологии днк in vivo.
- •Классификация днк-топоизомераз
- •Ядро эукариотической клетки и организация генома эукариот
- •Типичные характеристики гистонов млекопитающих
Регуляция топологии днк in vivo.
ДНК-топоизомеразы.
Классификация днк-топоизомераз
Несмотря на то, что остается все еще много неизвестного и непонятного в функционировании процессов, связанных с изменением топологии ДНК, к настоящему времени уже выделены, очищены до гомогенного состояния и достаточно неплохо охарактеризованы некоторые ферменты, имеющие самое непосредственное отношение к феномену суперспирализации. Эти ферменты, получившие название ДНК-топоизомераз, ответственны за регуляцию топологического состояния ДНК, которое выражается в изменении степени спирализованности данной молекулы. ДНК-топоизомеразы катализируют тонко согласованные во времени и пространстве процессы разрыва и воссоединения цепей ДНК, что приводит, в конце концов, к изменению степени спирализованности исходной ДНК. Некоторые топоизомеразы способны релаксировать только отрицательные супервитки в ДНК, другие могут релаксировать как положительно, так и отрицательно суперскрученные молекулы. Определенные топоизомеразы могут обеспечивать введение отрицательных супервитков. По этой причине они включаются в различные клеточные процессы, зависящие от необходимости разделения цепей ДНК. В зависимости от механизма каталитического действия топоизомеразы разделяют на два класса:
ДНК-топоизомеразы , являющиеся «раскрывающими-закрывающими» ферментами, осуществляют временные одноцепочечные разрывы, через которые протягивается интактная цепь ДНК, после чего концы разрыва воссоединяются. Эти ферменты участвуют в релаксации ДНК, уменьшая число отрицательных или положительных сверхвитков на единицу за один каталитический акт;
ДНК-топоизомеразы также являются «раскрывающими-закрывающими» ферментами, которые расщепляют фосфодиэфирные связи между двумя цепями в молекуле ДНК одновременно, протягивают через разрыв близлежащий сегмент ДНК и зашивают временно образовавшийся разрез. При этом за один каталитический акт вводятся или удаляются два супервитка.
ДНК-топоизомеразы были обнаружены во всех про- и эукариотических клетках. Бактериальные топоизомеразы типа I релаксируют только отрицательно суперспирализованную ДНК, в то время как эукариотические ферменты способны устранять отрицательные и положительные супервитки. Бактериальная ДНК-топоизомераза типа II, известная как ДНК-гираза, не только релаксирует, подобно эукариотическим ДНК-топоизомеразам II, отрицательные и положительные супервитки, но также способна вводить отрицательные супервитки в релаксированную ДНК. Благодаря этим особенностям ДНК-топоизомеразы I и II образуют своеобразный «шарнир», обеспечивающий беспрепятственное продвижение репликативной вилки в ходе удвоения ДНК, но только ДНК-топоизомеразы II, из-за своей способности осуществлять двухцепочечные разрывы, могут участвовать в разделении дочерних хромосом после завершения репликации.
Бактериальные топоизомеразы осуществляют кратковременные одноцепочечные разрывы отрицательно суперспирализованных дуплексов, приводя к релаксации суперспирализованной ДНК. В прошлом эти ферменты называли ферментами «разрезания-сшивки». Наиболее полно охарактеризованной ДНК-топоизомеразой типа является фермент, выделенный из клеток E. coli (устаревшее название – -белок). Этот фермент эффективно релаксирует ДНК, отрицательно суперспирализованную в высокой степени. Модель действия топоизомеразы E. coli представлена на рис. 3.17.
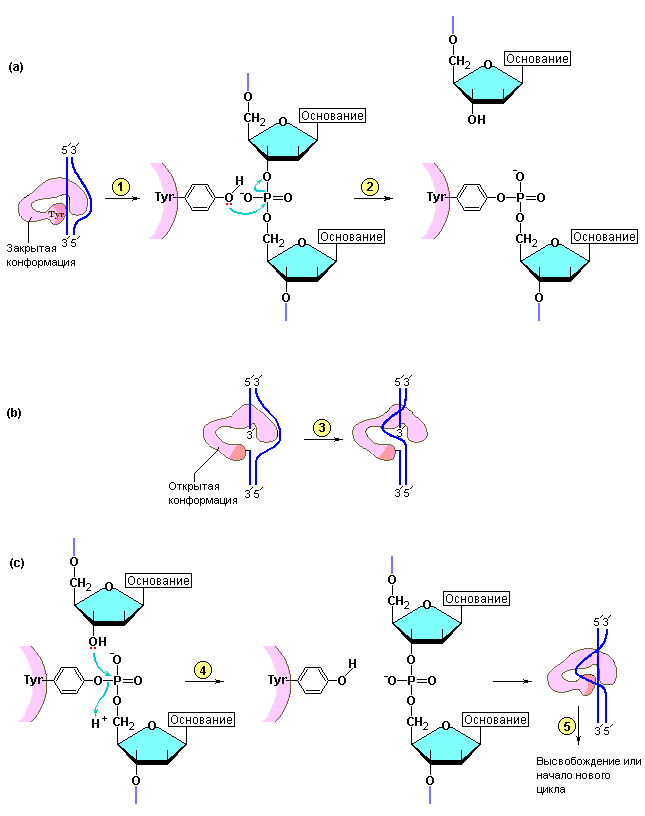
Рис. 3.17 |
Схема реакции, катализируемой топоизомеразами типа I. Бактериальные топоизомеразы типа I узнают сегменты с частично разделенными цепями ДНК (1), вносят разрыв в одну из цепей (2), протягивают вторую цепь через разрез, сделанный в первой цепи (3) и залечивают разрез (4,5) (Nelson D.L., Cox M.M., Lehninger Principles of Biochemistry, W.H. Freeman (ed.), San Francisco, 2004). |
Как следует из этого рисунка, на первой стадии реакции топоизомераза взаимодействует с областью, в которой произошло разделение двух цепей ДНК под влиянием отрицательной суперспирализации. На второй стадии реакции фермент разрезает одну из цепей, при этом топоизомераза удерживает образовавшиеся 3/- и 5/-концы и препятствует их свободному вращению. Образование стабильного комплекса топоизомеразы с ДНК определяется тем, что 5/-фосфатный конец разрезанной цепи ковалентно связывается с тирозиновым остатком в активном центре фермента (рис. 3.17).
Перенос фосфодиэфирной связи от нуклеиновой кислоты к белку объясняет, каким образом функционирует фермент, не требуя внешнего источника энергии. На следующей стадии топоизомераза I протаскивает через образовавшуюся брешь интактную цепь ДНК. И, наконец, на последней стадии топоизомераза заделывает брешь за счет восстановления фосфодиэфирных связей в молекуле ДНК.
ДНК-топоизомеразы эукариот, изученные гораздо слабее, формально имеют похожие свойства, однако они способны релаксировать как отрицательные, так и положительные суперспирали. Другим отличием эукариотических ДНК-топоизомераз типа I от бактериальных является образование в ходе реакции ковалентной связи между остатком тирозина и 3/-фосфатной группой разрезанной цепи ДНК.
ДНК-топоизомераза I человека является мономерным белком, кодируемым геном hTOP1. Охарактеризованы также два псевдогена – psi1-hTOP1 и psi2-hTOP1, которые локализованы в хромосомах 1 и 22, соответственно. Подобно другим эукариотическим ДНК-топоизомеразам I, топоизомераза человека катализирует релаксацию отрицательно или положительно суперспирализованных доменов с равной эффективностью. Промежуточный комплекс белок-ДНК образуется за счет ковалентного взаимодействия ОН-группы остатка тирозина и 3/-фосфатной группы разорванной цепи ДНК. Хотя биологическая роль ДНК-топоизомераз I млекопитающих не до конца выяснена, полагают, что эти ферменты выполняют функции «шарнира» в ходе репликации и транскрипции. Биохимические, иммунологические исследования и ингибиторный анализ указывают на то, что ДНК-топоизомераза I млекопитающих связана с транскрипционноактивным хроматином. Подавление топоизомеразной активности типа I влияет на инициацию и продолжение транскрипции в активном хроматине.
Топоизомеразы , как уже упоминалось, осуществляют двухцепочечные разрывы ДНК. Механизм действия бактериальной ДНК-топоизомеразы иллюстрирует схема, приведенная на рис. 3.18.

Рис. 3.18 |
Схематическое представление образования отрицательных супервитков (-) в релаксированной кольцевой двухцепочечной ДНК под действием ДНК-гиразы. 1 – образование структуры с положительным супервитком, 2 – надрезание дальнего дуплекса, 3 – воссоединение дуплекса с образованием двух отрицательных супервитков. |
ДНК-топоизомераза связывается с релаксированной молекулой ДНК и обеспечивает образование двух суперспирализованных петель, одна из которых является положительной, а другая, соответственно, отрицательной. На последующих стадиях фермент делает двухцепочечный разрыв, через который пропускает сегмент молекулы ДНК и зашивает брешь. Данная манипуляция обращает знак положительного супервитка (см. схему на рис. 3.18), приводя тем самым к введению двух отрицательных супервитков на каждый каталитический акт. Реакции, катализируемые ДНК-топоизомеразой протекают с затратами АТP. Дополнительные эксперименты с использованием негидролизуемых аналогов АТP показали, что в их присутствии фермент сохраняет способность вводить два отрицательных супервитка, но для того чтобы предпринять новый цикл суперспирализации ДНК-топоизомераза должна восстановить свою исходную конформацию. Полагают, что именно этот процесс приобретения ферментом исходной конформации осуществляется благодаря гидролизу АТP. Обработка одной из разновидностей ДНК-топоизомераз - ДНК-гиразы кишечной палочки налидиксовой кислотой позволила выделить ДНК в виде фрагментов, образованных в результате ступенчатого разрезания дуплексной молекулы. Концы разреза содержат свободные 3/-ОН группы, а 5/-фосфатные одноцепочечные уступы, протяженностью в 4 основания, ковалентно связаны с субъединицами фермента. Такая ковалентная сшивка сохраняет энергию фосфатной связи и она может быть использована для проведения реакции воссоединения концов, что объясняет способность фермента осуществлять релаксацию в отсутствие АТP. Показано также, что сайты, подвергающиеся разрезанию не характеризуются специфическими последовательностями, хотя некоторые последовательности являются более предпочтительными и встречаются примерно один раз на каждые 100 пар оснований.
В последние годы многие топоизомеразы II типа были выделены, очищены до гомогенного состояния и достаточно полно охарактеризованы. Наиболее изученными ферментами этого класса являются ДНК-топоизомераза фага Т4 и ДНК-гираза E. coli (см. раздел «Ключевые ферменты репликации ДНК»).
Эукариотические ДНК-топоизомеразы II являются АТР-зависимыми топоизомеразами, которые открывают и закрывают пробелы в дуплексе ДНК в ходе последовательно протекающих реакций. На первой стадии обе цепи ДНК расщепляются и 5/-фосфатные концевые группы каждой разрезанной цепи ковалентно связываются с остатками тирозина на отдельных субъединицах фермента. На второй стадии фосфотирозиновые связи расщепляются и восстанавливается целостность цепей ДНК. Надавно было показано, что, по крайней мере при разделении катенанов, на активность топоизомеразы II cущественное влияние оказывает степень метилирования соответствующих сайтов в ДНК.
У многих эукариотических организмов, включая Saccharomyces cerevisiae, Saccharomyces pombe, Drosophila melanogaster и людей, идентифицирован структурный ген ТОР2, кодирующий одну субъединицу фермента с молекулярной массой 170 000 дальтон. Исследования клеточных культур человека показывают, что в клетке имеется единственная копия гена ТОР2, локализованного в 17 хромосоме. Недавно был идентифицирован и картирован в 3 хромосоме второй структурный ген ТОР2Е1, кодирующий другую субъединицу с молекулярной массой 180 000 дальтон. Каталитическая активность топоизомеразы II возрастает в 2-3 раза в результате фосфорилирования под действием казеин-киназы II. Имеются указания на то, что топоизомерезы II необходимы для сегрегации реплицированных дочерних хромосом. Биологические функции ДНК-топоизомераз II млекопитающих, в отличие от ДНК-гиразы, изучены недостаточно полно. Тем не менее установлено, что активность этих ферментов важна для продвижения репликативной вилки. Следовательно ДНК-топоизомеразы типа II млекопитающих включаются в процесс репликации и, вполне вероятно, в процесс расхождения хромосомной ДНК. Поэтому не удивительно, что высокий уровень топоизомераз типа II обнаруживается в пролиферирующих клетках. В частности, при переходе клетки из состояния покоя к делению внутриклеточный уровень топоизомераз II возрастает в 100 раз.
В отличие от ДНК-топоизомеразы I, которая связана с транскрипционноактивным хроматином, ДНК-топоизомераза II равномерно распределена вдоль хромосом и, по-видимому, играет важную роль в формировании структуры хромосомы, конденсации ДНК, а также в организации ядерного матрикса. Иммуномикроскопические исследования подтвердили, что ДНК-топоизомераза II является одним из основных белков хромосомного остова, к которому прикреплены петли хроматина, характеризующиеся независимостью степени суперспирализации в каждой петле от торсионного состояния соседних петель.
Возможное участие ДНК-топоизомераз II в транскрипции РНК менее доказано. Исследования E. coli предполагают, что ДНК-гираза включается в процесс удаления положительных супервитков, генерируемых транскрипцией. Эукариотическая ДНК-топоизомераза II, которая гомологична бактериальной гиразе, может выполнять сходную функцию. Влияние на транскрипцию соединений, ингибирующих активность топоизомераз и изменяющих степень сверхспиральности ДНК, говорит о том, что топология ДНК – важный фактор регуляции транскрипции. Тем не менее у мутантов дрожжей, не имеющих ДНК-топоизомеразы I или ДНК-топоизомеразы II, транскрипция не нарушается. Это означает, что для транскрипции достаточно одной из этих двух эукариотических ДНК-топоизомераз.
Организация бактериального генома
Геномом называют полное количество ДНК, несущее всю сумму генетической информации для данного организма. Каждая бактериальная клетка содержит полный набор генетических «матриц» и функционирует более или менее независимо. Любая бактериальная клетка является гаплоидной, поскольку содержит один набор генов. В прокариотических клетках ДНК, по всей видимости, никогда не находится в свободной, вытянутой форме. Она связана с низкомолекулярными катионами – ионами двухвалентных металлов, либо с ди- и полиаминами или белками, а возможно, и с теми, и с другими. Взаимодействие осуществляется с помощью электростатических сил. Отрицательно заряженные фосфатные группы сахарофосфатного остова каждой цепи ДНК частично нейтрализуются положительно заряженными ионами металлов и полиаминами или оснóвными аминокислотными остатками белков. В результате таких взаимодействий происходит конденсация ДНК с уменьшением объема, занимаемого молекулой, иногда в тысячу и более раз. По этой причине достаточно большая кольцевая ДНК E. coli длиной 1,4 мм свободно «помещается» в клетке, имеющей форму палочки диаметром 1 мкм и длиной 2 мкм с объемом, равным приблизительно 1 мкм3.
У бактерий отсутствуют структуры, обладающие морфологическими признаками эукариотических хромосом. И все же их геномы характеризуются упорядоченной организацией, представленной в виде определенных структур – нуклеоидов.
У бактерий с частично реплицированной ДНК содержание дезоксирибонуклеиновой кислоты в нуклеоиде больше количества, соответствующего одному полному геному. К моменту деления бактериальной клетки генетический материал разделяется на два нуклеоида, которые распределяются между дочерними клетками. Механизм разделения нуклеоидов включает, по-видимому, этап прикрепления бактериального генома к определенному участку с внутренней стороны плазматической мембраны. По мере роста клетки эти два участка мембраны удаляются друг от друга, и после деления каждый участок с прикрепленным к нему нуклеоидом оказывается в соответствующей дочерней клетке.
Нуклеоиды из клеток E. coli были выделены в виде комплексов, которые на 80% (по массе) состояли из ДНК. Указанные комплексы можно перевести в менее компактно организованное состояние посредством обработки реагентами или ферментами, действующими на РНК или белки. Роль белков в конденсации бактериальной ДНК очевидна. При лизисе клеток E. coli высвобождаются нити в виде петель, прикрепленных к остаткам клеточной оболочки. ДНК в этих петлях находится не в виде свободно вытянутого дуплекса, а скручена в более компактные образования благодаря ее связи с белками. Насколько известно, в упаковке прокариотической геномной ДНК участвуют только два или три типа белков. О природе взаимодействия этих белков с ДНК и о структуре конденсированного комплекса белок-ДНК известно немного. У E. coli, по-видимому, существует два класса ДНК-связывающих белков, которые по своему размеру, содержанию лизина и аргинина, антигенным свойствам сходны с эукариотическими гистонами (см. далее). Это белок HU, состоящий из двух неидентичных субъединиц по 9.000 дальтон, каждая и белок Н, включающий две идентичные субъединицы с молекулярной массой 28.000 дальтон. Белок HU по своим свойствам напоминает эукариотический гистон Н2А, а другой белок – белок Н, обнаруженный у E. coli и цианобактерий, по повышенному содержанию лизина и ДНК-связывающим свойствам сходен с другим гистоном – Н2В. Белки HU и Н обнаружены в клетках E. coli в количествах, достаточных для образования комплекса, по меньшей мере, с половиной ДНК и, по-видимому, совместно с полиаминами и другими белками (например, белками HLP1 и Р) могут выполнять те же функции при конденсации и упаковке бактериальной ДНК, что и пять эукариотических гистонов.
В соответствии с существующей моделью (рис. 2.7), бактериальная хромосома имеет доменное строение, при этом каждый домен состоит из одной петли ДНК, концы которой зафиксированы так, что вращательное движение не передается из одного домена в другой. В настоящее время полагают, что в расчете на один геном число таких доменов может равняться 45-100 (по данным разных авторов). При этом ДНК в комплексе с белками формирует компактную структуру нуклеоида.
Роль, которую может играть РНК в стабилизации нуклеоида, не совсем ясна. Попытки выделить специфическую РНК, участвующую в образовании данной структуры, оказались безуспешными. Однако нельзя не учитывать результаты отдельных экспериментов, которые свидетельствуют об определенном вкладе РНК в организацию хромосомы E. coli (рис. 2.1).
Как следует из рис. 2.7, нуклеоид E. coli представлен структурой, включающей приблизительно 50 петель суперспирализованной ДНК, которые организованы центральным РНК-содержащим остовом. Обработка нуклеоида ДНК-азой приводит лишь к постепенной релаксации ДНК в индивидуальных доменах (петлях). С другой стороны, РНК-аза в одну стадию полностью «разрушает» организацию хромосомы E. coli, что может служить определенным доказательством участия РНК в формировании и поддержании структуры нуклеоида.
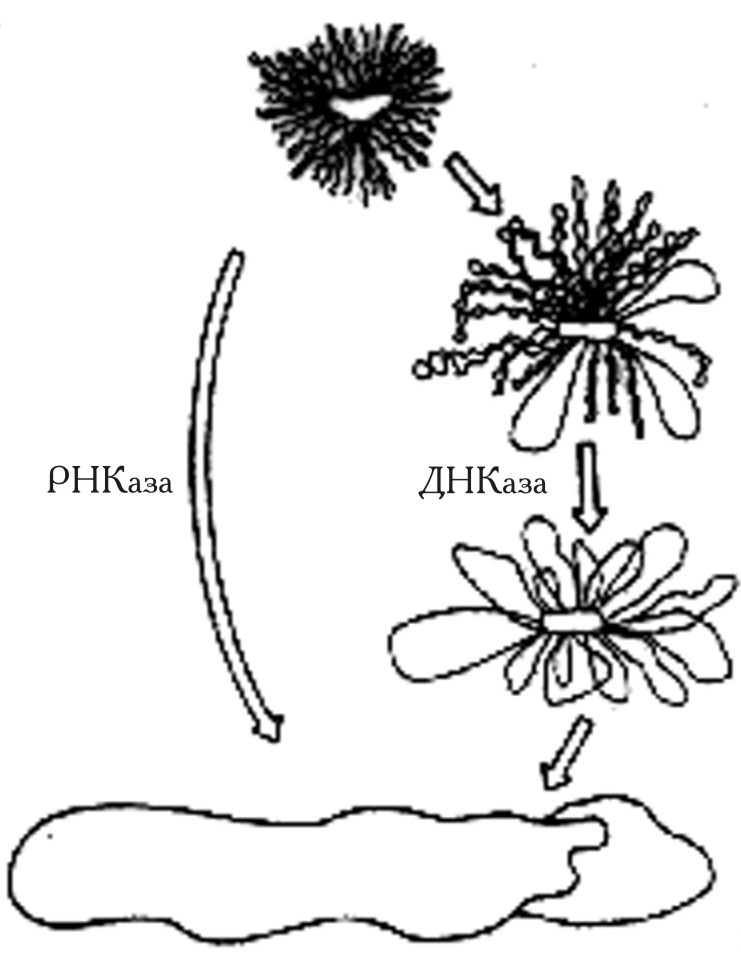
Рис. 2.1 |
Схематическое изображение структуры нуклеоида E. coli (Worcel A., Burgi E., J. Mol. Biol., 1972, 71, 123-131). |
В заключение следует отметить, что бактериальные клетки представляют исключительную ценность для исследований в области биохимии и молекулярной биологии. Это связано с тем, что они относительно не сложны по структуре, их можно легко и быстро выращивать на простых средах (глюкоза, NH4Cl, неорганические вещества), а механизмы репродукции и передачи генетической информации у них достаточно просты и, вместе с тем, почти универсальны.
Другой важной особенностью прокариотических клеток является их способность размножаться не половым путем, а простым делением надвое.
И, наконец, в связи с тем, что прокариоты содержат только одну хромосому, у них можно легко индуцировать образование генетических мутантов, характеризующихся быстрым фенотипическим проявлением.
Благодаря этим свойствам бактерии сыграли важную роль в формировании современных представлений об основных молекулярных процессах, обеспечивающих передачу и реализацию генетической информации.
