
- •Методические указания по выполнению практических работ
- •«Топливо и теория горения»
- •Составление условной формулы бртт и расчет калорийности бртт по методу де-Поу
- •Всего……………..100%
- •Результаты расчета сводятся в таблицу 1.
- •Исходя из таблицы коэффициентов по Де-Поу и состава топлива, получим
- •Определение энергетических характеристик и состава продуктов сгорания бртт
- •Водяного газа от температуры
- •Цель работы - освоение методики теоретического определения зависимости скорости горения топлива в рдтт от различных факторов.
- •Определение скорости горения топлива в условиях обтекания газовым потоком
- •Определение параметров горения твердого топлива
- •Определение коэффициента теплопроводности продуктов сгорания топлива
Исходя из таблицы коэффициентов по Де-Поу и состава топлива, получим
Qж = 37,8·56,1+71,2·28,3+12,1·0+94,3·2+136·1=4460 кДж/кг.
ПРАКТИЧЕСКАЯ РАБОТА №2
Определение энергетических характеристик и состава продуктов сгорания бртт
ЦЕЛЬ РАБОТЫ - освоение методики расчёта энергетических характеристик БРТТ и состава продуктов сгорания.
ИСХОДНЫЕ ДАННЫЕ
Условная формула топлива в варианте индивидуального задания выдаётся преподавателем.
Пример условной формулы для БРТТ:
CaHbOcNd = C23,0H30,03O34,42N10,01,
где a, b, c, d – число грамм-атомов соответствующих элементов в 1кг топлива.
ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ
1.Определение состава продуктов сгорания
Реакция горения БРТТ в общем виде может быть записана следующим образом:
CaHbOcNd = xCO2 +
yCO + zH2 + uH2O +
![]() N2
,
N2
,
где x, y, z, u, - число грамм-молекул газов, содержащихся в продуктах сгорания топлива.
Задаваясь рядом значений температур, по формулам
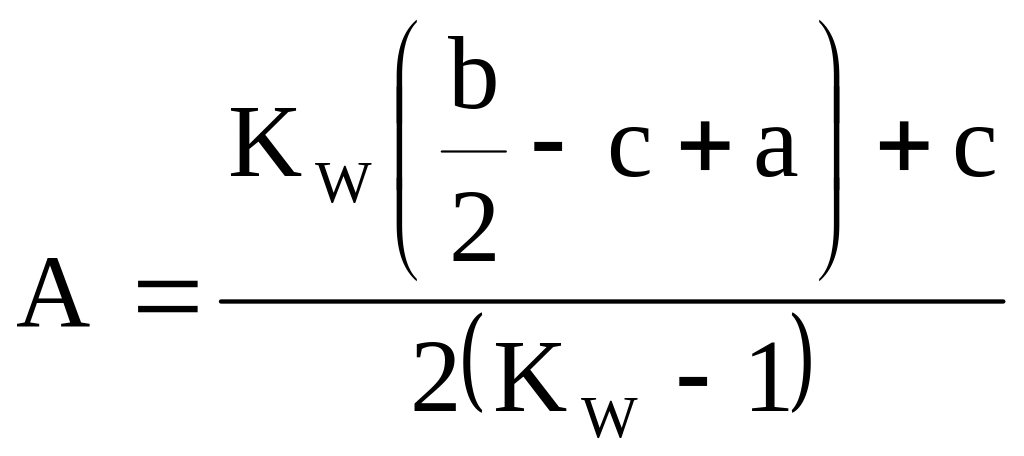 ;
;
![]() ;
;
y = a
– x ; u =
c – a – x
;
![]() ,
,
рассчитываются значения x, y, z, u грамм-молекул газов, содержащихся в продуктах сгорания топлива. Значения константы равновесия водяного газа KW в зависимости от температуры определяются по таблице 1.
Таблица 1 – Зависимость константы равновесия
Водяного газа от температуры
-
Т, К
300
600
800
1000
1200
1400
1600
1800
2000
KW
0
0,04
0,24
0,71
1,40
2,19
3,06
3,80
4,55
-
Т, К
2200
2400
2600
2800
3000
KW
5,21
5,78
6,22
6,59
6,92
Результаты расчета для различных температур сводятся в таблицу 2.
Таблица 2 – Результаты расчета продуктов сгорания топлива
Т,К |
3000 |
2800 |
2600 |
2400 |
2200 |
2000 |
1800 |
1600 |
1200 |
800 |
300 |
CO2 |
|
|
|
|
|
|
|
|
|
|
|
CO |
|
|
|
|
|
|
|
|
|
|
|
Н2О |
|
|
|
|
|
|
|
|
|
|
|
Н2 |
|
|
|
|
|
|
|
|
|
|
|
N2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
где – число молей продуктов сгорания, моль/кг.
2. По таблице 3 для каждого газа при соответствующей температуре определяем энтальпии и умножаем на число молей данного газа для 1 кг топлива.
Таблица 3 - Теплосодержание газов, кДж/моль.
-
Т К
CO2
CO
H2O
H2
N2
300
9,46
8,75
10,01
6,57
8,75
400
13,36
11,6
13,4
9,34
11,64
500
17,67
14,65
16,75
12,81
14,65
600
22,32
17,59
20,43
16,96
17,59
800
32,24
23,87
27,89
21,1
23,74
1000
42,87
30,52
35,88
29,18
30,19
1200
54,43
37,1
44,3
35,25
36,8
1400
65,65
44,05
53,17
41,58
43,67
1600
77,17
51,17
62,34
48,02
50,33
1800
89,1
58,32
72,18
54,68
57,74
2000
101,2
65,53
82,19
61,47
64,94
2200
113,38
73,06
92,45
68,33
72,18
2400
125,69
80,06
102,87
75,45
79,43
2600
138,13
87,51
113,55
82,487
86,75
2800
150,65
94,96
124,35
89,85
94,12
3000
163,21
102,37
135,24
97,14
101,58
Сумма энтальпий всех газов дает энтальпию продуктов сгорания 1 кг топлива H = iHi .
Внутренняя энергия продуктов сгорания вычисляется по формуле
U=H-R1T=H-RT ,
где H – энтальпия;
R1 – газовая постоянная продуктов сгорания;
R–универсальная газовая постоянная, R=8,314 Дж/(мольК);
Т – температура.
3. Средние теплоёмкости продуктов сгорания при постоянном давлении и постоянном объёме в интервале температур от 0 до Т градусов Кельвина равны:
![]() =
=![]() ;
;
![]() =
=![]() ,
,
а соотношение теплоёмкостей:
![]() =
=![]() .
.
Средние значения теплоёмкостей в некотором интервале температур Т определяются из выражений:
![]() =
=![]() ;
;
![]() =
=![]() .
.
Результаты расчёта для различных температур заносятся в таблицу 4.
Таблица 4 – Результаты расчёта
-
Т К
3000
2400
2000
1600
1200
800
300
H
R1T
U
По результатам расчёта строятся графики функций H(T) и U(T), схематично представленные на рис 1.
4. По рассчитанному значению Qж при выполнении лабораторной работы №1,
используя графики U(T) и H(T), определяется температура горения при посто-
янном объёме T0v и температура горения при постоянном давлении T0p.
Затем определяется сила пороха fv = R1 T0v и приведенная сила пороха
fp = R1 T0p.
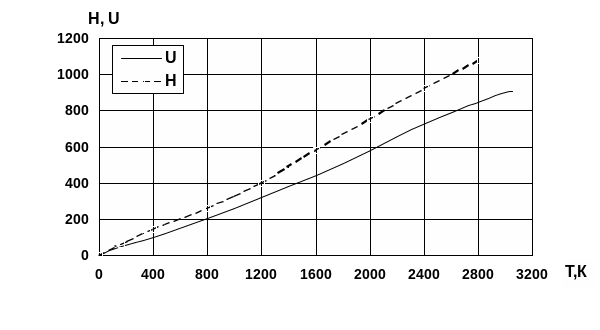
Рис. 1

ПРАКТИЧЕСКАЯ РАБОТА №3
Определение скорости горения топлива в РДТТ
