
- •Часть I. Теоретическая химия
- •Глава 1. Основные понятия и законы химии
- •§ 1.1. Задачи с решениями
- •§ 1.2. Задачи для самостоятельного решения
- •1.2.1. Задачи на расчет числа молей
- •1.2.2. Задачи на определение формул веществ
- •1.2.3. Расчеты по химическим уравнениям
- •1.2.4. Задачи на смеси
- •1.2.5. Задачи на газовые законы
- •Глава 2. Строение атома и периодический закон
- •§ 2.1. Задачи с решениями
- •§ 2.2. Задачи для самостоятельного решения
- •2.2.1. Электронные конфигурации и Периодическая система
- •2.2.2. Изотопы и радиоактивные превращения
- •Глава 3. Химическая связь
- •§ 3.1. Задачи с решениями
- •§ 3.2. Задачи для самостоятельного решения
- •3.2.1. Типы химической связи и их характеристики
- •3.2.2. Валентность. Степени окисления элементов. Геометрическая структура молекул.
- •3.2.3. Строение и свойства вещества
- •Глава 4. Закономерности протекания химических реакций
- •§ 4.1. Задачи с решениями
- •§ 4.2. Задачи для самостоятельного решения
- •4.2.1. Энергетика химических превращений
- •4.2.2. Химическая кинетика и катализ
- •4.2.3. Обратимые и необратимые реакции. Состояние химического равновесия.
- •Глава 5. Растворы электролитов и неэлектролитов
- •§ 5.1. Задачи с решениями
- •§ 5.2. Задачи для самостоятельного решения
- •5.2.1. Способы выражения концентрации растворов
- •5.2.2. Ионные реакции в растворах
- •Глава 6. Окислительно-восстановительные процессы. Ряд напряжений. Электролиз растворов и расплавов.
- •§ 6.1. Задачи с решениями
- •§ 6.2. Задачи для самостоятельного решения
- •6.2.1. Окислители и восстановители
- •6.2.2. Составление уравнений овр и подбор коэффициентов
- •6.2.3. Влияние pH среды на характер протекания овр
- •6.2.4. Электрохимический ряд напряжений
- •6.2.5. Электролиз растворов и расплавов
- •Часть II. Неорганическая химия
- •Глава 7. Номенклатура, классификация, свойства и способы получения неорганических веществ
- •§ 7.1. Задачи с решениями
- •§ 7.2. Задачи для самостоятельного решения
- •7.2.1. Важнейшие классы неорганических соединений
- •7.2.2. Классификация химических реакций
- •7.2.3. Гидролиз солей
- •Глава 8. Водород. Галогены.
- •§ 8.1. Задачи с решениями
- •§ 8.2. Задачи для самостоятельного решения
- •8.2.1. Водород
- •8.2.2. Галогены и их соединения
- •Глава 9. Элементы подгруппы кислорода
- •§ 9.1. Задачи с решениями
- •§ 9.2. Задачи для самостоятельного решения
- •9.2.1. Кислород и его соединения
- •9.2.2. Сера и ее соединения
- •Глава 10. Подгруппа азота и фосфора
- •§ 10.1. Задачи с решениями
- •§ 10.2. Задачи для самостоятельного решения
- •10.2.1. Азот и его соединения
- •10.2.2. Фосфор и его соединения
- •Глава 11. Подгруппа углерода и кремния
- •§ 11.1. Задачи с решениями
- •§ 11.2. Задачи для самостоятельного решения
- •11.2.1. Углерод и его соединения
- •11.2.2. Кремний и его соединения
- •Глава 12. Металлы главных подгрупп (щелочные, щелочноземельные, алюминий)
- •§ 12.1. Задачи с решениями
- •§ 12.2. Задачи для самостоятельного решения
- •12.2.1. Щелочные металлы
- •12.2.2. Щелочноземельные металлы
- •12.2.3. Алюминий и его соединения
- •Глава 13. Главные переходные металлы
- •§ 13.1. Задачи с решениями
- •§ 13.2. Задачи для самостоятельного решения
- •13.2.1. Железо и его соединения
- •13.2.2. Медь и ее соединения
- •13.2.3. Серебро и его соединения
- •13.2.4. Хром и его соединения
- •13.2.5. Марганец и его соединения
- •Часть III. Органическая химия
- •Глава 14. Общая характеристика органических соединений
- •§ 14.1. Задачи с решениями
- •§ 14.2. Задачи для самостоятельного решения
- •Глава 15. Предельные углеводороды
- •§ 15.1. Задачи с решениями
- •§ 15.2. Задачи для самостоятельного решения
- •15.2.1. Строение, номенклатура, изомерия
- •15.2.2. Получение
- •15.2.3. Химические свойства
- •Глава 16. Углеводороды с двойной связью
- •§ 16.1. Задачи с решениями
- •§ 16.2. Задачи для самостоятельного решения
- •16.2.1. Строение, номенклатура, изомерия
- •16.2.2. Получение
- •16.2.3. Химические свойства
- •Глава 17. Алкины
- •§ 17.1. Задачи с решениями
- •§ 17.2. Задачи для самостоятельного решения
- •17.2.1. Строение, номенклатура, изомерия
- •17.2.2. Получение
- •17.2.3. Химические свойства
- •Глава 18. Ароматические углеводороды (арены)
- •§ 18.1. Задачи с решениями
- •§ 18.2. Задачи для самостоятельного решения
- •18.2.1. Строение, номенклатура, изомерия
- •18.2.2. Получение
- •18.2.3. Химические свойства
- •Глава 19. Спирты. Фенолы
- •§ 19.1. Задачи с решениями
- •§ 19.2. Задачи для самостоятельного решения
- •19.2.1. Строение, номенклатура, изомерия
- •19.2.2. Получение
- •19.2.3. Химические свойства
- •Глава 20. Альдегиды. Кетоны
- •§ 20.1. Задачи с решениями
- •§ 20.2. Задачи для самостоятельного решения
- •20.2.1. Строение, номенклатура, изомерия
- •20.2.2. Получение
- •20.2.3. Химические свойства
- •Глава 21. Карбоновые кислоты и их производные
- •§ 21.1. Задачи с решениями
- •§ 21.2. Задачи для самостоятельного решения
- •21.2.1. Строение, номенклатура, изомерия карбоновых кислот
- •21.2.2. Получение карбоновых кислот
- •21.2.3. Химические свойства карбоновых кислот
- •21.2.4. Сложные эфиры
- •21.2.5. Жиры
- •Глава 22. Углеводы
- •§ 22.1. Задачи с решениями
- •§ 22.2. Задачи для самостоятельного решения
- •22.2.1. Моносахариды
- •Глава 23. Амины
- •§ 23.1. Задачи с решениями
- •§ 23.2. Задачи для самостоятельного решения
- •23.2.1. Строение, номенклатура, изомерия
- •23.2.2. Получение
- •23.2.3. Химические свойства
- •Глава 24. Аминокислоты и пептиды
- •§ 24.1. Задачи с решениями
- •§ 24.2. Задачи для самостоятельного решения
- •24.2.1. Строение и изомерия
- •24.2.2. Получение и химические свойства
- •Глава 25. Азотсодержащие гетероциклические соединения
- •§ 25.1. Задачи с решениями
- •§ 25.2. Задачи для самостоятельного решения
- •25.2.1. Гетероциклические основания
- •25.2.2. Нуклеиновые кислоты
- •Часть IV варианты вступительных экзаменов
- •Глава 26. Вступительные экзамены в Московском государственном университете
- •Глава 27. Вступительные экзамены в Московской медицинской академии
- •Глава 28. Решения избранных вариантов вступительных экзаменов
Глава 28. Решения избранных вариантов вступительных экзаменов
В этой главе приведены эталонные решения половины экзаменационных вариантов, представленных в главах 26 и 27. Необходимо иметь в виду, что многие решения не являются единственно верными, т.к. часть заданий допускает несколько правильных решений.
Решение варианта CО-95-3
1.

10 -электронов.
2. а) Окислительные свойства:
SO2 + 2H2S = 3S + 2H2O,
t
SO2 + 3Mg MgS + 2MgO.
б) Восстановительные свойства:
SO2 + Br2 + 2H2O = H2SO4 + 2HBr,
5SO2 + 2KMnO4 + 2H2O = K2SO4 + 2MnSO4 + 2H2SO4.
3. Это вещество — карбонат аммония, (NH4)2CO3.
(NH4)2CO3 + 2CH3COOH = 2CH3COONH4 + CO2 + H2O,
t
(NH4)2CO3 + 2KOH K2CO3 + 2NH3 + 2H2O,
3(NH4)2CO3 + 2AlCl3 + 3H2O = 2Al(OH)3 + 3CO2 + 6NH4Cl.
4. 2H2S + 3O2 = 2SO2 + 2H2O, (1)
NaOH + SO2 = NaHSO3, (2)
2NaOH + SO2 = Na2SO3 + H2O, (3)
Na2SO3 + Ca(NO3)2 = CaSO3 + 2NaNO3. (4)
(H2O) = (SO2) = (H2S) = 4,48 / 22,4 = 0,2 моль.
(NaOH) = 57,41,220,2 / 40 = 0,35 моль.
Пусть x моль SO2 вступило в реакцию (2), y моль SO2 — в реакцию (3), тогда
![]()
x = 0,05, y = 0,15.
m(р-ра) = m(р-ра NaOH) + m(H2O) + m(SO2) = 57,41,22 + 0,218 + 0,264 = 86,4 г.
(NaHSO3) = x = 0,05, m(NaHSO3) = 0,05104 = 5,2 г, (NaHSO3) = 5,2 / 86,4 = 0,0602 = 6,02%.
(Na2SO3) = y = 0,15, m(Na2SO3) = 0,15126 = 18,9 г, (Na2SO3) = 18,9 / 86,4 = 0,219 = 21,9%.
(CaSO3) = (Na2SO3) = 0,15, m(CaSO3) = 0,15120 = 18,0 г.
Ответ. (NaHSO3) = 6,02%, (Na2SO3) = 21,9%; m(CaSO3) = 18,0 г.
H3PO4
5. 1) C6H6 + CH3CH=CH2 C6H5CH(CH3)2
“A”
h
2) C6H5CH(CH3)2 + Br2 C6H5CBr(CH3)2 + HBr
“Б”
C2H5OH
3) C6H5CBr(CH3)2 + KOH C6H5C(CH3)=CH2 + KBr + H2O
“В”
H2, Ni
4) C6H5C(CH3)=CH2 + H2 C6H5CH(CH3)2
“Г”
5)

“Д”
6) 5BrC6H4CH(CH3)2 + 18KMnO4 + 27 H2SO4 = 5BrC6H4COOH + 10CO2 + 9K2SO4 + 18MnSO4 + 42H2O.
“Е”
x x/2 2x x/4
6. 4Fe(NO3)2 = 2Fe2O3 + 8NO2 + O2
y y/2 3y 3y/4
4Fe(NO3)3 = 2Fe2O3 + 12NO2 + 3O2
Пусть в исходной смеси содержалось x моль Fe(NO3)2 и y моль Fe(NO3)3, тогда в газовой смеси находится (2x + 3y) моль NO2 и (x/4 + 3y/4) моль O2.
6(2x + 3y) + 32(x/4 + 3y/4)
Mср(NO2,O2) = =
(2x + 3y) + (x/4 + 3y/4)
= 401,09 = 43,6,
откуда y = 1,27x.
m(исх. смеси) = m(Fe(NO3)2) + m(Fe(NO3)3) = 180x + 242y = 486,5x.
m(кон. смеси) = m(Fe2O3) = 160(x/2 + y/2) = 181,3x.
Масса смеси после прокаливания уменьшилась в 486,5 / 181,3 = 2,68 раза.
Ответ. В 2,68 раза.
7. Реакция вещества “А” с Fe + HCl свидетельствует о том, что в состав соединения входит группа NO2. Радикал C8H9 принадлежит к ряду ароматических радикалов (CnH2n-7). 6 атомов углерода образуют ароматическое ядро, а два атома углерода находятся в боковых цепях. Поскольку при окислении число атомов углерода не изменяется, это означает, что в молекуле “А” было две группы CH3 (если бы была одна группа C2H5, то при окислении число атомов углерода уменьшилось бы на единицу: C2H5 COOH + CO2). Таким образом, вещество “А” — диметилнитробензол. Существует 6 изомерных диметилнитробензолов:
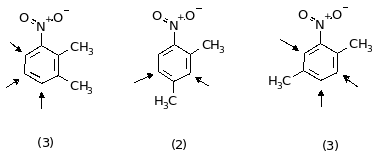
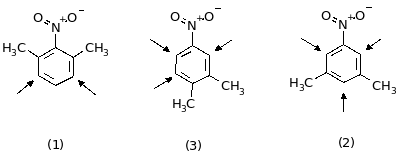 (в
скобках приведено число возможных
монобромпроизводных, стрелки указывают
направления замещения). Число
монобромпроизводных определяется
правилами ориентации (CH3
— ориентант 1-го рода, NO2
— 2-го рода) и симметрией молекулы. Всем
условиям задачи удовлетворяют два
изомера: второй и шестой.
(в
скобках приведено число возможных
монобромпроизводных, стрелки указывают
направления замещения). Число
монобромпроизводных определяется
правилами ориентации (CH3
— ориентант 1-го рода, NO2
— 2-го рода) и симметрией молекулы. Всем
условиям задачи удовлетворяют два
изомера: второй и шестой.
Уравнения реакций:
(CH3)2C6H3NO2 + 3Fe + 7HCl = (CH3)2C6H3NH2 + 3FeCl2 + 2H2O,
5(CH3)2C6H3NO2 + 12KMnO4 + 18H2SO4 = 5(HOOC)2C6H3NO2 + 6K2SO4 + 12MnSO4 + 28H2O.
Решение варианта С-95-4
1. 4-нитрофенол — более сильная кислота за счет –М-эффекта нитрогруппы.
2. CaCl2 + CH3COOK /
N2H4 + HCl [N2H5Cl] (N2H4 — основание Льюиса)
3. Реактив — подкисленный раствор KMnO4.
CH3COONa + KMnO4 /
5H2CO + 4KMnO4 + 6H2SO4 = 5CO2 + 2K2SO4 + 4MnSO4 + 11H2O,
5C2H5OH + 4KMnO4 + 6H2SO4 = 5CH3COOH + 2K2SO4 + 4MnSO4 + 11H2O.
4. KAlO2 + 4HCl = KCl + AlCl3 + 2H2O,
“X1”
AlCl3 + 3NH3 + 3H2O = Al(OH)3 + 3NH4Cl,
t
2Al(OH)3 Al2O3 + 3H2O,
“X2”
сплавление
Al2O3 + 2KOH 2KAlO2 + H2O.
5. а) 2HI + H2O2 = I2 + 2H2O;
б) 3C6H5CH=CH2 + 2KMnO4 + 4H2O 3C6H5CH(OH)CH2OH + 2MnO2 + 2KOH,
C6H5CH=CH2 + 2KMnO4 + 3H2SO4 C6H5COOH + CO2 + K2SO4 + 2MnSO4 + 4H2O;
в) Ca3(PO4)2 + 6HCl = 3CaCl2 + 2H3PO4.
0,1 0,1
6. CaSO3 + 2HCl = CaCl2 + H2O + SO2
(HCl) = 500,2 / 36,5 = 0,274, (CaSO3) = 12 / 120 = 0,1 — недостаток.
1) m1 = m(р-ра HCl) – m(SO2) = 50 – 0,164 = 43,6 г.
2) Пусть m(р-ра HCl) = x, m(HCl) = 0,1x, m(H2O) = 0,9x
Cr2S3 + 6HCl = 2CrCl3 + 3H2S
Cr2S3 + 6H2O = 2Cr(OH)3 + 3H2S
Пусть Cr2S3 вступает в реакции полностью: (Cr2S3) = 12 / 200 = 0,06.
(HCl) + (H2O) = 0,066 = 0,36 = 0,1x / 36,5 + 0,9x / 18, откуда x = 6,83 г. При добавлении 6,83 г 10%-ной соляной кислоты Cr2S3 прореагирует полностью, при этом выделится 0,063 = 0,18 моль H2S массой 0,1834 = 6,12 г. При дальнейшем добавлении соляной кислоты растворяется Cr(OH)3, но масса стакана не изменяется.
m1 = 43,6 = m(р-ра HCl) – m(H2S), откуда m(р-ра HCl) = 43,6 + 6,12 = 49,72 г.
Ответ. m(р-ра HCl) = 49,72 г.
0,15 0,15
7. CH3COOC2H5 + NaOH CH3COONa + C2H5OH,
C3H7OH + NaOH /
(CH3COOC2H5) = 16,50,8 / 88 = 0,15, (NaOH) = 0,06258 = 0,5.
После упаривания в твердой смеси остались 0,15 моль CH3COONa и 0,35 моль NaOH, которые реагируют друг с другом при прокаливании:
0,15 t 0,15
CH3COONa + NaOH CH4 + Na2CO3.
После реакции: (Na2CO3) = 0,15, m(Na2CO3) = 0,15106 = 15,9 г, (NaOH) = 0,35 – 0,15 = 0,2, m(NaOH) = 0,240 = 8,0 г.
(Na2CO3) = 15,9 / 23,9 = 0,665 = 66,5%,
(NaOH) = 8,0 / 23,9 = 0,335 = 33,5%,
Ответ. (Na2CO3) = 66,5%, (NaOH) = 33,5%.
Решение варианта B-95-3
1.

2. 2FeBr3 + H2S = 2FeBr2 + S + 2HBr (FeBr3 – окислитель);
2FeBr3 + 3Cl2 = 2FeCl3 + 3Br2 (FeBr3 — восстановитель).
3. CCl3CH=CH2 + HCl CCl3CH2CH2Cl
(присоединение против правила Марковникова за счет –I эффекта группы CCl3);
H2O
CCl3CH2CH2Cl + 4KOH HOOCCH2CH2OH + 4KCl + H2O.
4. 1)

2)

3)

Способ обнаружения: водно-спиртовой раствор 4-нитропиридина окрашивает лакмус в синий цвет:

5. 1) BaSO3 + H2O2 = BaSO4 + H2O
X1 — сульфат бария, BaSO4;
t
2) BaSO4 + 2C BaS + 2CO2;
3) BaS + 2HCl = BaCl2 + H2S
X2 — хлорид бария, BaCl2;
4) BaCl2 + H2SO4 = BaSO4 + 2HCl;
5) BaCl2 + Na2SO3 = BaSO3 + 2NaCl.
6. (Cu(NO3)2) = 2350,2 / 188 = 0,25; m(NO3–) = 0,25262 = 31,0 г; (BaCl2) = 1500,208 / 208 = 0,15.
Масса раствора после электролиза равна
m(NO3–) / (NO3–) = 31,0 / 0,092 = 337,0 г.
За счет электролиза масса раствора уменьшилась на m = 235 + 150 – 337 = 48,0 г. Для такого уменьшения массы электролиз должен был происходить в три этапа.
I этап. На катоде разряжаются ионы меди, на аноде — ионы хлора:
0,15 0,3 0,15
Cu2+ + 2e Cu
0,3 0,3 0,15
2Cl– – 2e Cl2 (Cl– — в недостатке)
m1 = m(Cu) + m(Cl2) = 0,1564 + 0,1571 = 20,25 г; (e) = 0,3; в растворе осталось 0,1 моль ионов Cu2+.
II этап. На катоде разряжаются ионы меди, на аноде — ионы OH–:
0,1 0,2 0,1
Cu2+ + 2e Cu (Cu2+ — в недостатке)
0,2 0,05
4OH– – 4e O2 + 2H2O
m2 = m(Cu) + m(O2) = 0,164 + 0,0532 = 8,0 г; (e) = 0,2.
III этап. Электролиз воды: на катоде разряжаются ионы H+, на аноде — ионы OH–:
2,2 1,1
2H+ + 2e H2
2,2 0,55
4OH– – 4e O2 + 2H2O
Масса воды, подвергшейся электролизу по уравнению 2H2O = 2H2 + O2: m3 = 48 – 20,25 – 8,0 = 19,8 г, (H2O) = 19,8 / 18 = 1,1 = (H2). (e) = 2,2.
Таким образом, на катоде выделилось (0,15+0,1)64 = 16,0 г Cu и 1,12 = 2,2 г H2, на аноде — 0,1571 = 10,6 г Cl2 и (0,05+0,55)32 = 19,2 г O2. Через раствор прошло (0,3+0,2+2,2) = 2,7 моль электронов зарядом 2,796500 = 260550 Кл.
Ответ. Катод: 16,0 г Cu, 2,2 г H2; анод: 10,6 г Cl2, 19,2 г O2. Q = 260550 Кл.
7. CxHyOz + O2 xCO2 + y/2 H2O
Mср(H2O,CO2) = mRT / (pV) = RT / p = 1,0008,314473 / 113,3 = 34,71 г/моль.
34,71 = (44x + 18y/2) / (x + y/2), откуда x = 0,9y, т.е. (C):(H) = 9:10.
Из девяти атомов углерода шесть входят в состав ароматической системы, один — в состав альдегидной группы (реакция с [Ag(NH3)2]OH) и два атома находятся в метильных группах (при окислении CH3 COOH не происходит выделения CO2). Существует шесть диметилбензойных альдегидов, различающихся положением метильных групп относительно альдегидной группы (-2,3; -2,4; -2,5; -2,6; -3,4; -3,5). Из них только один изомер (-2,6) дает единственное мононитропроизводное (с учетом правил ориентации и симметрии молекулы):

(CH3)2C6H3CHO + 2[Ag(NH3)2]OH = (CH3)2C6H3COONH4 + 2Ag + 3NH3 + H2O,
5(CH3)2C6H3CHO + 14KMnO4 + 21H2SO4 = 5(HOOC)2C6H3COOH + 7K2SO4 + 14MnSO4 + 31H2O.
Ответ. 2,6-диметилнитробензол.
Решение варианта М-95-2
1. CO2 + 2NaOH = Na2CO3 + H2O.
t
2. 1) 2Cu2O + C 4Cu + CO2;
t
2) CaCO3 + 4C CaC2 + 3CO2;
3) 3Cu2O + 14HNO3 = 6Cu(NO3)2 + 2NO + 7H2O.
AlCl3
3. 1) C6H6 + C2H5Cl C6H5C2H5 + HCl;
“A”
h
2) C6H5C2H5 + Cl2 C6H5CHClCH3 + HCl;
“B”
C2H5OH
3) C6H5CHClCH3 + KOH C6H5CH=CH2 + KCl + H2O;
“C”
4) 3C6H5CH=CH2 + 10KMnO4 3C6H5COOK + 3K2CO3 + 10MnO2 + KOH + 4H2O.
“D”
4. Из а) и б) следует, что вещество может представлять собой двухатомный спирт. Из в) следует, что оно не содержит атомов галогенов и карбоксильной группы. Наконец, один из трех атомов углерода должен иметь 4 разных заместителя (асимметрический атом углерода, обеспечивающий оптическую активность, т.е. существование оптических изомеров). Возможная формула вещества:

Звездочкой обозначен асимметрический атом углерода. Уравнения реакций:
2HOCH2CHOHCH3 + Cu(OH)2 + 2KOH = = K2[Cu(OCH2CH(CH3)O)2] + 4H2O;
HOCH2CHOHCH3 + 2HBr CH3CHBrCH2Br + 2H2O.
5. 1) CaC2 + 2H2O = Ca(OH)2 + C2H2
X1 — гидроксид кальция, Ca(OH)2;
2) Ca(OH)2 + 2CH3COOH = (CH3COO)2Ca + 2H2O;
3) (CH3COO)2Ca + Na2CO3 = CaCO3 + 2CH3COONa.
X2 — карбонат кальция, CaCO3;
t
4) CaCO3 + 4C CaC2 + 3CO2.
6. С калием реагируют пиррол и бутанол-2:

z z/2
CH3CH(OH)CH2CH3 + K 2CH3CH(OK)CH2CH3 + 1/2H2
Пусть (C4H4NH) = x, (CH3C5H4N) = y, (C4H9OH) = z, тогда
(H2) = PV / RT = 6,01101,3 / (8,31293) = 0,25 = x/2 + z/2.
После гидрирования пиррол превращается в пирролидин (x моль), 3-метилпиридин — в 3-метилпиперидин (y моль):


С соляной кислотой реагируют все три вещества, находящиеся в смеси после гидрирования:
z z
CH3CH(OH)CH2CH3 + HCl CH3CHClCH2CH3 + H2O


(HCl) = 76,040,36 / 36,5 = 0,75 = x + y + z
![]()
y = 0,25; m(CH3C5H4N) = 0,2593 = 23,25 г.
Ответ. m(3-метилпиридина) = 23,25 г.
7. CH3CH=CH2 + H2 <==> C3H8
Пусть (C3H6) = x, (H2) = 1–x, тогда масса смеси равна
42x + 2(1–x) = 215 = 30, откуда x = 0,7, т.е. (C3H6) = 0,7, (H2) = 0,3.
Давление уменьшилось на 25% при неизменных температуре и объеме за счет уменьшения на 25% числа молей в результате реакции. Пусть y молей H2 вступило в реакцию, тогда после реакции осталось: (C3H6) = 0,7–y, (H2) = 0,3–y, (C3H8) = y, общ = 0,75 = (0,7–y) + (0,3–y) + y, откуда y = 0,25. Теоретически могло образоваться 0,3 моль C3H8 (H2 — в недостатке), поэтому выход равен 0,25 / 0,3 = 0,833 = 83,3%.
Константа равновесия при данных условиях равна:
![]()
2) Пусть во втором случае (C3H6) = a, (H2) = 1–a, тогда масса смеси равна
42a + 2(1–a) = 216 = 32, откуда a = 0,75, т.е. (C3H6) = 0,75, (H2) = 0,25. Пусть в реакцию вступило b молей H2. Это число можно найти из условия неизменности константы равновесия:
![]()
Из двух корней данного квадратного уравнения выбираем корень, удовлетворяющий условию: 0 < b < 0,25, т.е. b = 0,214.
Общее число молей газов после реакции равно общ = (0,75–0,214) + (0,25–0,214) + 0,214 = 0,786, т.е. оно уменьшилось на 21,4% по сравнению с исходным количеством (1 моль). Давление пропорционально числу молей, поэтому оно также уменьшилось на 21,4%.
Ответ. Выход C3H8 — 83,3%. Давление уменьшится на 21,4%.
Решение варианта CО-96-1
1. Общая формула алифатических одноатомных спиртов:

где R, R', R'' — предельные алифатические радикалы или атомы водорода. Для того, чтобы спирт мог существовать в виде двух оптических изомеров, необходимо и достаточно, чтобы R, R', R'' были разными. В простейшем случае это H, CH3, C2H5:

Это вещество называется бутанол-2. Его оптические изомеры:
2. Уравнение реакции:
5 объемов 2 объема
S2Cl2 + 3H2SO4 = 5SO2 + 2HCl + 2H2O.
(SO2) = 5 / 7 = 0,714 = 71,4%, (HCl) = 2 / 7 = 0,286 = 28,6%.
3. С соляной кислотой могут реагировать амины, аминокислоты, соли карбоновых кислот и алкены:
RNH2 + HCl = RNH3Cl,
H2N–CH(R)–COOH + HCl = Cl[H3N–CH(R)–COOH],
RCOONa + HCl = RCOOH + NaCl,
R–CH=CH2 + HCl R–CHCl–CH3.
4. Эта задача допускает несколько решений. Одно из них такое: X1 — CaCO3, X2 — Ca(NO3)2. Уравнения реакций:
Ca(HCO3)2 + Ca(OH)2 = 2CaCO3 + 2H2O,
t
CaCO3 CaO + CO2,
Ca(HCO3)2 + 2HNO3 = Ca(NO3)2 + 2CO2 + 2H2O,
t
2Ca(NO3)2 2CaO + 4NO2 + O2,
CaCO3 + 2HNO3 = Ca(NO3)2 + CO2 + H2O,
Ca(NO3)2 + Na2CO3 = CaCO3 + 2NaNO3.
5. Первая реакция — это дегидроциклизация гептана (промышленный способ получения толуола):

При бромировании толуола в кольцо могут образоваться два монобромпроизводных: 2-бромтолуол (орто-изомер) и 4-бромтолуол (пара-изомер). Из реакции В Г далее следует, что образовался 4-бромтолуол (см. ниже):

При окислении 4-бромтолуола метильная группа превращается в карбоксильную, и образуется 4-бромбензойная кислота:

Группа –COOH — мета-ориентант, а –Br — орто-пара-ориентант, поэтому при нитровании 4-бромбензойной кислоты первая нитрогруппа может попасть только в положение 3:

Если бы во второй реакции образовался 2-бромтолуол, то вещество В представляло бы собой 2-бромбензойную кислоту, и замещение водорода на нитрогруппу могло бы происходить в положения 3 и 5, при этом образовалась бы смесь двух мононитропроизводных.
Цинк в солянокислом растворе восстанавливает нитрогруппу до аминогруппы, которая присоединяет одну молекулу хлороводорода:

Диметиламин отнимает хлороводород у аминогруппы, связанной с бензольным кольцом, и одновременно реагирует как основание с карбоксильной группой:

6. Галогениды фосфора могут иметь формулу PX3 или PX5 (X — атом галогена). При их гидролизе образуется галогеноводородная кислота и фосфористая или фосфорная кислота:
1 моль 1 моль 3 моля
PX3 + 3H2O = H3PO3 + 3HX
1 моль 1 моль 5 молей
PX5 + 4H2O = H3PO4 + 5HX
Для полной нейтрализации продуктов гидролиза 1 моля PX3 потребуется 5 молей KOH (H3PO3 — двухосновная кислота):
1 моль 2 моля
H3PO3 + 2KOH = K2HPO3 + 2H2O
3 моля 3 моля
HX + KOH = KX + H2O
Аналогично, для полной нейтрализации продуктов гидролиза 1 моля PX5 потребуется 8 молей KOH:
1 моль 3 моля
H3PO4 + 3KOH = K3PO4 + 3H2O
5 молей 5 молей
HX + KOH = KX + H2O
(KOH) = c V = 2 моль/л 0,035 л = 0,07 моль.
Рассмотрим сначала вариант галогенида фосфора (III):
(PX3) = (KOH) / 5 = 0,014 моль,
M(PX3) = m / = 1,23 г / 0,014 моль = 88 г/моль,
A(X) = (88 – 31) / 3 = 19 г/моль.
X — фтор, искомый галогенид — PF3.
В случае галогенида фосфора (V):
(PX5) = (KOH) / 8 = 0,00875 моль,
M(PX5) = m / = 1,23 г / 0,00875 моль = 140,6 г/моль,
A(X) = (140,6 – 31) / 5 = 21,9 г/моль — не подходит.
Ответ. PF3.
7. Эта задача допускает несколько решений, простейшее из которых — следующее. Одинаковый элементный состав (т.е., одинаковые элементы с одинаковыми массовыми долями) имеют все углеводороды состава CnH2n (алкены и циклоалканы). Действительно, (C) = 12n / (12n + 2n) = 6/7, (H) = 2n / (12n + 2n) = 1/7.
Уравнения сгорания имеют следующий вид:
CxH2x + 3x/2 O2 = xCO2 + xH2O
CyH2y + 3y/2 O2 = yCO2 + yH2O
CzH2z + 3z/2 O2 = zCO2 + zH2O
По условию задачи, на сгорание одного моля CxH2x требуется столько же молей кислорода, что и для сжигания смеси, состоящей из одного моля CyH2y и одного моля CzH2z. Это означает, что 3x/2 = 3y/2 + 3z/2, то есть x = y + z. Теперь найдем x, y и z.
По условию, углеводороды Б и В изомерны между собой, причем других изомеров не имеют. Из всех веществ состава CnH2n два изомера имеет только C3H6 — пропен и циклопропан (y = 3, z = 3). Отсюда следует, что в состав вещества А входят шесть атомов углерода (x = y + z = 6). Из всех веществ состава C6H12 только циклогексан дает при бромировании единственное монобромпроизводное:

Таким образом, А — циклогексан, Б — пропен CH3–CH=CH2, В — циклопропан.
Решение варианта C-96-1
1. Молекулярная формула нитрофенола C6H5NO3 (C6H4(OH)NO2). Гомологи нитрофенола отличаются от него на n групп CH2 и имеют общую формулу Cn+6H2n+5NO3. 11 атомов водорода (n =3) имеет, например, 2-пропил-4-нитрофенол:

2. Этот реагент — AgNO3:
HBr + AgNO3 = AgBr + HNO3
NaF + AgNO3 /
2KOH + 2AgNO3 = Ag2O + H2O + 2KNO3
AlCl3 + 3AgNO3 = 3AgCl + Al(NO3)3
AgBr — желтоватый осадок, Ag2O — черно-бурый, AgCl — белый.
3. Рассмотрим треугольник, образованный атомом азота и двумя атомами фтора:

По теореме косинусов, r(F–F)2 = 2r(N–F)2 – 2r(N–F)2 cos FNF, откуда cos FNF = –0,209, FNF = 102o.
Это означает, что молекула NF3 представляет собой неправильную треугольную пирамиду с вершиной в атоме азота, ребра пирамиды — равнобедренные треугольники. Пирамидальная форма свидетельствует о том, что атом азота находится в состоянии sp3-гибридизации.
4. X1 — CuO:
2Cu2O + O2 = 4CuO
CuO + H2SO4 = CuSO4 + H2O
X2 — Cu:
CuSO4 + Fe = FeSO4 + Cu
Cu + Cl2 = CuCl2
X3 — Cu(OH)2:
CuCl2 + 2KOH = Cu(OH)2 + 2KCl
2Cu(OH)2 + CH3CH=O Cu2O + CH3COOH + 2H2O
5. C6H12O6 2C2H5OH + 2CO2 (спиртовое брожение глюкозы)
140 oC, H2SO4
C2H5OH C2H4 + H2O
C2H4 + Cl2 C2H4Cl2
C2H5OH
C2H4Cl2 + 2KOH C2H2 + 2KCl + 2H2O
C, 600 oC
3C2H2 C6H6
H2SO4
C6H6 + HNO3 C6H5–NO2 + H2O
C6H5–NO2 + 3(NH4)2S C6H5–NH2 + 3S + 2NH4OH + 4NH3
6. В парах уксусная кислота находится частично в виде димеров, а частично в виде отдельных молекул:
x молей x/2 молей
2CH3COOH (CH3COOH)2
Исходное количество уксусной кислоты: (CH3COOH) = m / M = 5,4 / 60 = 0,09 моль. Пусть в реакцию димеризации вступило x молей CH3COOH, тогда образовалось x/2 молей димера (CH3COOH)2 и осталось (0,09 – x) молей CH3COOH.
Общее количество веществ в газовой фазе равно:
= PV / (RT) = 43,7 4,50 / (8,31 473) = 0,05 = x/2 + (0,09 – x),
откуда x = 0,08 моль. Число молекул димера уксусной кислоты в газовой фазе равно:
N[(CH3COOH)2] = NA = 0,08 / 2 6,02 1023 = 2,408 1022
Ответ. 2,408 1022 молекул (CH3COOH)2.
7. Щелочной гидролиз обычных сложных эфиров происходит в соответствии с уравнением:
R–CO–O–R' + NaOH RCOONa + R'OH
"Б"
Если для реакции гидролиза нужно вдвое большее количество щелочи, то это означает, что R'OH реагирует с щелочью, то есть R'OH — фенол или его гомолог:
0,0025 моль 0,005 моль
R''–CO–O–C6H4–R''' + 2NaOH R''COONa + "А" + NaO–C6H4–R''' + H2O
Таким образом, вещество Б — сложный эфир спирта, а вещество А — сложный эфир фенола или его гомолога.
Найдем молярную массу сложного эфира А по второму уравнению:
(NaOH) = c V = 0,1 моль/л 0,05 л = 0,005 моль,
(R''–CO–O–C6H4–R''') = (NaOH) / 2 = 0,0025 моль,
M(R''–CO–O–C6H4–R''') = m / = 0,375 г / 0,0025 моль = 150 г/моль,
M(R'' + R''') = 150 – M(CO–O–C6H4) = 30 г/моль.
Возможны три варианта распределения 30 г/моль между радикалами R'' и R''': 1) R'' = H, R''' = C2H5; 2) R'' = CH3, R''' = CH3; 3) R'' = C2H5, R''' = H. Первый вариант отпадает, поскольку эфир не дает реакции серебряного зеркала и, следовательно, не является эфиром муравьиной кислоты.
Рассмотрим второй вариант: CH3–CO–O–C6H4–CH3. Оба заместителя в бензольном кольце — и CH3–CO–O и CH3 — орто-пара-ориентанты. С учетом этого можно определить число мононитропроизводных, образующихся при нитровании эфира. Преимущественные направления нитрования для орто-, мета- и пара-изомеров эфира А показаны стрелочками:

Условию задачи удовлетворяет мета-изомер, то есть сложный эфир уксусной кислоты и мета-крезола:

Третий вариант, в котором вещество А представляет собой сложный эфир пропионовой кислоты и фенола: C2H5COOC6H5, не подходит, т.к. при нитровании этого эфира преимущественно образуются только два мононитропроизводных, в которых нитрогруппы находятся в орто- и пара-положениях по отношению к группе C2H5COO–.
В сложном эфире Б бензольное кольцо находится со стороны кислоты. Эфир может быть образован бензойной кислотой и этанолом

или метилбензойной кислотой (3 изомера) и метанолом:

Решение варианта B-96-2
1. Простейший амин, который имеет структурные изомеры — это C2H7N. Изомеры: CH3CH2NH2 (этиламин) и CH3NHCH3 (диметиламин).
2. а) K2Cr2O7 + 3SO2 + H2SO4 = K2SO4 + Cr2(SO4)3 + H2O
б) 2K2CrO4 + 3KNO2 + 2KOH + 5H2O = 3KNO3 + 2K3[Cr(OH)6]
3. Фрагменты А входят в состав целлюлозы, следовательно А — -глюкоза (изображена в пиранозной форме, т.е. в форме 6-членного цикла):

Смесь линейной формы глюкозы, -глюкозы и -глюкозы образуется при гидролизе следующего дихлорида:
CH2OH–(CHOH)4CHCl2 + H2O C6H12O6 + 2HCl
(гидролиз дихлоридов — один из способов получения альдегидов).
Вещество Б — -глюкоза в пиранозной форме:

4. 1) 3C2H5OH + 4Na2CrO4 + 7NaOH + 4H2O = = 3CH3COONa + 4Na3[Cr(OH)6]
2) CH3COOC2H5 + NaOH = CH3COONa + C2H5OH
3) 5C2H5OH + 4KMnO4 + 6H2SO4 = 5CH3COOH + 2K2SO4 + 4MnSO4 + 11H2O
4) CH3COONa + C2H5I = CH3COOC2H5 + NaI
5) CH3COONa + HCl = CH3COOH + NaCl
t, H2SO4
6) CH3COOH + C2H5OH CH3COOC2H5 + H2O
5. а) Окисление FeCl2 концентрированной серной кислотой:
2FeCl2 + 4H2SO4 = Fe2(SO4)3 + SO2 + 4HCl + 2H2O
б) окисление PH3 водным раствором перманганата калия:
3PH3 + 8KMnO4 = 8MnO2 + 2K3PO4 + K2HPO4 + 4H2O
в) реакция между водными растворами CuSO4 и Na2CO3 (взаимный гидролиз):
2CuSO4 + 2Na2CO3 + H2O = [Cu(OH)]2CO3 + 2Na2SO4 + CO2
г) вытеснение глицерина из глицерата натрия уксусной кислотой:
NaOCH2–CHONa–CH2ONa + 3CH3COOH HOCH2–CHOH–CH2OH + 3CH3COONa
6. При нагревании перманганат калия разлагается:
0,06 t 0,03 0,03 0,03
2KMnO4 = K2MnO4 + MnO2 + O2
Масса смеси уменьшается за счет выделившегося кислорода:
(O2) = m / M = (22,12 – 21,16) / 32 = 0,03 моль. В результате реакции также образовалось 0,03 моль K2MnO4, 0,03 моль MnO2 и израсходовано 0,06 моль KMnO4. Перманганат калия разложился не весь. После реакции он остался в смеси в количестве (KMnO4) = 22,12/158 – 0,06 = 0,08 моль.
Все три вещества, находящиеся в конечной смеси (KMnO4, K2MnO4, MnO2), — сильные окислители и при нагревании окисляют соляную кислоту до хлора:
0,08 0,64 0,2
2KMnO4 + 16HCl = 5Cl2 + 2KCl + 2MnCl2 + 8H2O
0,03 0,24 0,06
K2MnO4 + 8HCl = 2Cl2 + 2KCl + MnCl2 + 4H2O
0,03 0,12 0,03
MnO2 + 4HCl = Cl2 + MnCl2 + 2H2O
(Cl2) = (0,08 5/2) + (0,03 2) + 0,03 = 0,29 моль,
V(Cl2) = 0,29 22,4 = 6,50 л.
(HCl) = (0,08 16/2) + (0,03 8) + (0,03 4) = 0,96 моль,
m(HCl) = M = 0,96 36,5 = 35,04 г,
m(р-ра HCl) = m(HCl) / (HCl) = 35,04 / 0,365 = 96,0 г,
V(р-ра HCl) = m / = 96,0 / 1,18 = 81,4 мл.
Ответ. V(Cl2) = 0,29 22,4 = 6,50 л, V(р-ра HCl) = 81,4 мл.
7. Ключевая идея задачи состоит в том, что при гидролизе эфира образуется вещество, реагирующее с аммиачным раствором оксида серебра, то есть альдегид или спирт с тройной связью в конце углеродной цепи. Альдегид образуется при изомеризации непредельных спиртов вида HO–CH=CHR, в которых гидроксильная группа находится при двойной связи. Непредельные спирты такого типа не выделены, поскольку они быстро изомеризуются, однако существуют их простые и сложные эфиры, которые изомеризоваться не могут. Таким образом, уравнение реакции гидролиза имеет вид:
0,00845 0,00845
R’–CO–O–CH=CH–R + KOH R’COOK + O=CH–CH2–R
где R’ — ароматический радикал CnH2n–7. Образующийся альдегид вступает в реакцию серебряного зеркала
0,00845 0,01689
RCH2CH=O + 2[Ag(NH3)2]OH RCH2COONH4 + 2Ag + 3NH3 + H2O
(Ag) = m / M = 1,824 / 108 = 0,01689 моль,
(RCH2CH=O) = (Ag) / 2 = 0,00845 моль,
(R’–CO–O–CH=CH–R) = (RCH2CH=O) = 0,00845 моль,
M(R’–CO–O–CH=CH–R) = m / = 1,368 / 0,00845 = 162 г/моль,
M(R’+R) = 162 – M(CO–O–CH=CH) = 162 – 70 = 92 г/моль.
Если R’ = CnH2n–7, а R = CmH2m+1, то получаем уравнение
(12n + 2n – 7) + (12m + 2m + 1) = 92
откуда n + m = 7, при этом n 6 (ароматический радикал).
Этому условию удовлетворяют два набора чисел: n = 6, m = 1 или n = 7, m = 0. В первом случае имеем эфир бензойной кислоты:

Набор чисел n = 7, m = 0 соответствует виниловым эфирам метилбензойных кислот (3 изомера):

В случае, если спирт содержит тройную связь на конце цепи, уравнения реакций выглядят следующим образом:
R’–CO–O–R–CCH + KOH R’COOK + HO–R–CCH
HO–R–CCH + [Ag(NH3)2]OH HO–R–CCAg + 2NH3 + H2O.
Этот случай анализировать намного сложнее, чем предыдущий, и неизвестно, есть ли здесь разумные выражения для R и R’. Попробуйте разобрать этот вариант самостоятельно.
Ответ. C6H5–CO–O–CH=CH–CH3 или CH3–C6H4–CO–O–CH=CH2 (3 изомера).
Решение варианта M-96-1
1. M = RT / P = 1,165 0,082 293 / 1 = 28 г/моль — это оксид углерода (II) CO.
2. Сульфат алюминия надо прокалить:
t
Al2(SO4)3 = Al2O3 + 3SO2 + 3/2O2
Твердый остаток надо расплавить и подвергнуть электролизу:
2Al2O3 = 4Al + 3O2
Выделившиеся газы надо пропустить через сероводородную кислоту:
2H2S + SO2 = 3S + 2H2O
3. При нитровании монодейтеробензола C6H5D на нитрогруппу с почти равной вероятностью может замещаться любой из пяти атомов водорода или атом дейтерия, поэтому a 17%. Уравнение замещения дейтерия имеет вид:

Если в орто-положение к дейтерию ввести нитрогруппу, которая является мета-ориентантом, то нитрование пойдет преимущественно в следующие положения (указаны стрелочками):

Выход продукта замещения дейтерия на нитрогруппу по уравнению

уменьшится, поскольку орто-положение, в котором находится дейтерий по отношению к нитрогруппе, не является благоприятным для нитрования.
4. Циклическая формула целлобиозы:

Звездочкой обозначен гликозидный гидроксил, который может замещаться на группу –OCH3 при реакции с метанолом:

Благодаря наличию гликозидного гидроксила целлобиоза может в водном растворе превращаться в линейную форму с альдегидной группой (подобно глюкозе), поэтому она дает реакцию серебряного зеркала (уравнение приведено в упрощенном виде):
NH3
C12H22O11 + Ag2O C12H22O12 + 2Ag
Монометиловый эфир целлобиозы не содержит гликозидного гидроксила, поэтому он не может существовать в линейной форме и не вступает в реакцию серебряного зеркала.
5. 1) Ag2O + 2HCl = 2AgCl + H2O
2) 2AgNO3 + 2KOH = Ag2O + 2KNO3 + H2O
3) 3Ag + 4HNO3 = 3AgNO3 + NO + 2H2O
4) 2Ag + Cl2 = 2AgCl
5) [Ag(NH3)2]2SO4 + Ba(OH)2 = 2[Ag(NH3)2]OH + BaSO4
6) [Ag(NH3)2]OH + CH3–CCH CH3–CCAg + 2NH3 + H2O
7) 2CH3–CCAg + H2SO4 = Ag2SO4 + 2CH3–CCH
8) Ag2SO4 + 4NH3 = [Ag(NH3)2]2SO4
9) [Ag(NH3)2]2SO4 + 6HCl = 2AgCl + 4NH4Cl + H2SO4
10) Ag2O + 4NH3 + H2O = 2[Ag(NH3)2]OH
11) CH3–CCAg + HNO3 = AgNO3 + CH3–CCH
12) 2Ag + 2H2SO4(конц) = Ag2SO4 + SO2 + 2H2O
6. Общая формула неизвестной соли NaClOx, где x = 1 4. Уравнение окисления иодида калия имеет общий вид:
0,012 / x 0,012
NaClOx + 2x KI + x H2SO4 = NaCl + x I2 + x K2SO4 + + x H2O
(I2) = m / M = 3,05 / 254 = 0,012 моль, (NaClOx) = 0,012 / x моль. С другой стороны, (NaClOx) = m / M = 0,543 / (23 + 35,5 + 16x) моль. Из уравнения
0,012 / x = 0,543 / (23 + 35,5 + 16x)
находим x = 2. Искомая соль — хлорит натрия NaClO2.
Все кислородсодержащие соли хлора при сильном нагревании разлагаются на хлорид и кислород:
t
NaClO2 = NaCl + O2
Из 1 моля NaClO2 (90,5 г) образуется 1 моль NaCl (58,5 г). Потеря массы составляет 32 г, или 32 / 90,5 100% = 35,4%.
Ответ. NaClO2. Потеря массы 35,4%.
7. Общая формула рибонуклеотида

Полный гидролиз этого вещества идет по уравнению:
0,01 0,01
Рибонуклеотид + 2H2O = H3PO4 + C5H10O5 + азотистое основание
Образующаяся фосфорная кислота реагирует с известковой водой:
0,01 0,005
3Ca(OH)2 + 2H3PO4 = Ca3(PO4)2 + 6H2O
(Ca3(PO4)2) = m / M = 1,55 / 310 = 0,005 моль,
(H3PO4) = 2 (Ca3(PO4)2) = 0,01 моль,
(рибонуклеотида) = (H3PO4) = 0,01 моль,
M(рибонуклеотида) = m / = 3,63 / 0,01 = 363 г/моль.
В одном моле рибонуклеотида содержится азота:
m(N) = 363 0,1928 = 70 г, (N) = m / M = 70 / 14 = 5 моль. Это означает, что в состав азотистого основания входят 5 атомов азота. Таких оснований в составе нуклеотидов может быть два: аденин и гуанин. Молярной массе нуклеотида 363 г/моль соответствует гуанин. Таким образом, искомый рибонуклеотид — гуанозинфосфат:
Решение варианта СО-97-3
1. а) Единственный альдегид, который может быть получен гидратацией алкина, — ацетальдегид, который образуется из ацетилена:
Hg2+, H+
C2H2 + H2O CH3CH=O
б) Остальные алкины при реакции с водой дают кетоны, поэтому любые альдегиды, кроме ацетальдегида, не могут быть получены гидратацией алкина.
2. Валентности элементов: O – II, H – I, C – IV, Mg – II, P – V. Степени окисления отдельных атомов приведены ниже (обратите внимание на различные степени окисления атомов углерода):
 .
.
3. P+3 и Br– — сильные восстановители, поэтому оба элемента окисляются азотной кислотой: P+3 — до фосфорной кислоты, а Br– — до брома. Азотная кислота восстанавливается до NO2:
PBr3 + HNO3 H3PO4 + Br2 + NO2 + H2O.
Для нахождения коэффициентов в уравнении реакции используем электронно-ионный баланс:
1 2PBr3 + 8H2O – 10e 2H3PO4 + 3Br2 + 10H+
10 NO3– + 2H+ + e NO2 + H2O
2PBr3 + 10HNO3 = 2H3PO4 + 3Br2 + 10NO2 + 2H2O.
В результате реакции образуются кислота и кислотный оксид, поэтому в качестве вещества, реагирующего со всеми продуктами реакции, можно предложить щелочь:
NaOH + H3PO4 = NaH2PO4 + H2O ;
2NaOH + 2NO2 = NaNO3 + NaNO2 + H2O.
Бром также реагирует со щелочами (по аналогии с хлором):
6NaOH + 3Br2 = 5NaBr + NaBrO3 + 3H2O.
Можно предложить и другое решение. Br2 и NO2 — сильные окислители, поэтому надо найти такой сильный восстановитель, который реагировал бы с фосфорной кислотой. Подойдет любой активный металл, например кальций:
Ca + 2H3PO4 = Ca(H2PO4)2 + H2,
Ca + Br2 = CaBr2,
7Ca + 2NO2 = 4CaO + Ca3N2 (нагревание кальция в атмосфере NO2).
Ответ. NaOH или Ca.
4. Вся схема разбивается на три более простые схемы с одним неизвестным промежуточным веществом в каждой из них. Рассмотрим, например, вещество X1. Скорее всего, X1 — соль марганца (II), которая получается при восстановлении MnO2 в кислой среде. В зависимости от того, какая кислота использовалась для создания кислой среды, из MnO2 можно получить хлорид (бромид, иодид), сульфат или нитрат марганца (II). Однако Mn(NO3)2 нельзя превратить в MnF2 по обменной реакции, а MnBr2 использован в другой части схемы. Наиболее естественный выбор: X1 — MnCl2. Уравнения реакций:
MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O,
MnCl2 + 2AgF = MnF2 + 2AgCl.
Аналогично можно проанализировать две другие части схемы. Надо только следить за тем, чтобы X2 и X3 не совпадали друг с другом, с X1 и с обозначенными в схеме соединениями марганца. Одно из возможных решений: X2 — Mn(OH)2, X3 — Mn(NO3)2. Уравнения реакций:
MnF2 + 2NaOH = Mn(OH)2 + 2NaF,
Mn(OH)2 + 2HBr = MnBr2 + 2H2O,
MnBr2 + 2AgNO3 = Mn(NO3)2 + 2AgBr,
Mn(NO3)2 = MnO2 + 2NO2 (при нагревании).
Ответ. X1 — MnCl2, X2 — Mn(OH)2, X3 — Mn(NO3)2.
5. В этой задаче два необычных момента. Во-первых, отсутствуют стрелки в схеме, и направления реакций можно выбирать самостоятельно; это облегчает задачу. Во-вторых, в схеме даны не конкретные вещества, а гомологические ряды; это усложняет задачу, поскольку для ее решения нужно хорошо представлять взаимосвязь разных классов органических соединений.
Попробуем расшифровать гомологические ряды. CnH2n–6 и CnH2n–8 — вероятнее всего, ароматический углеводород и его производное с двойной связью в боковой цепи. Вещество состава Cn–1H2n–10O2 содержит два атома кислорода, которые могут входить в состав карбоксильной группы COOH. Если из Cn–1H2n–10O2 вычесть COOH, то получится Cn–2H2n–11, что соответствует ароматическому радикалу (CmH2m–7 при m = n–2). Таким образом, Cn–1H2n–10O2 — ароматическая кислота, что подтверждается также образованием калиевого производного Cn–1H2n–11KO2.
Для определения конкретного значения n надо заметить, что при переходе от CnH2n–6 к Cn–1H2n–10O2 число атомов углерода уменьшается на единицу. Это означает, что один атом углерода из боковой цепи окисляется до CO2. Это возможно только, если n = 8, а CnH2n–6 — этилбензол, C6H5CH2CH3. В этом случае CnH2n–8 — стирол, C6H5CH=CH2; Cn–1H2n–10O2 — бензойная кислота, C6H5COOH; Cn–1H2n–11KO2 — бензоат калия, C6H5COOK. Приведем уравнения реакций.
1) Стирол можно окислить до бензоата калия с разрывом двойной связи сильным окислителем в щелочной среде:
C6H5CH=CH2 + 10KMnO4 + 13KOH C6H5COOK + 10K2MnO4 + K2CO3 + 8H2O.
Бензоат калия превращается в бензойную кислоту при подкислении водного раствора:
C6H5COOK + HCl C6H5COOH + KCl.
Обратное превращение происходит под действием щелочи:
C6H5COOH + KOH C6H5COOK + H2O.
3) Этилбензол можно окислить до бензоата калия перманганатом калия в водной среде:
C6H5CH2CH3 + 4KMnO4 C6H5COOK + K2CO3 + KOH + 2H2O.
Для превращения стирола в бензойную кислоту надо использовать сильный окислитель в кислой среде:
C6H5CH=CH2 + 2KMnO4 + 3H2SO4 C6H5COOH + CO2 + K2SO4 + 2MnSO4 + 4H2O.
5) Этилбензол обратимо дегидрируется в стирол при нагревании с катализатором:
 .
.
6) Этилбензол окисляется до бензойной кислоты под действием кислого раствора перманганата калия:
5C6H5CH2CH3 + 12KMnO4 + 18H2SO4 5C6H5COOH + 5CO2 + 6K2SO4 + 12MnSO4 + 28H2O.
Записывая органические уравнения с коэффициентами, нужно понимать, что на самом деле химики-органики не пользуются такими уравнениями, поскольку очень редкие органические реакции идут со 100%-ным выходом. Кроме того, органика не интересует, во что превращается неорганический окислитель — в MnO2 или в MnSO4. Задача органика — выделить органический продукт по возможности с хорошим выходом. Поэтому химик-профессионал запишет уравнение окисления этилбензола в виде схемы:
 .
.
Тем не менее, если в условии сказано “напишите уравнения реакций”, схемами ограничиваться нельзя, и в уравнении надо указывать все участвующие в реакции вещества с коэффициентами.
Ответ. n = 8; этилбензол, стирол, бензойная кислота, бензоат калия.
6. При добавлении сульфита калия к раствору бромида бария происходит обменная реакция:
0,1 0,15 0,1 0,2
BaBr2 + K2SO3 = BaSO3 + 2KBr.
(K2SO3) = 23,7 / 158 = 0,15 моль, (BaBr2) = 150 0,198 / 297 = 0,1 моль — недостаток. В результате реакции сульфита бария образовалось (BaSO3) = 0,1 моль, в растворе осталось (0,15–0,1) = 0,05 моль K2SO3.
SO2 в первую очередь реагирует с находящимся в растворе K2SO3 по уравнению ((SO2) = 2,24 / 22,4 = 0,1 моль — избыток):
0,05 0,05 0,1
K2SO3 + SO2 + H2O = 2KHSO3.
Оставшиеся (0,1–0,05) = 0,05 моль SO2 частично растворяют осадок:
0,05 0,05 0,05
BaSO3 + SO2 + H2O = Ba(HSO3)2.
После этой реакции осадка осталось (BaSO3) = 0,1 – 0,05 = 0,05 моль. Масса осадка равна m(BaSO3) = 0,05 217 = 10,85 г.
В конечном растворе находятся 0,2 моль KBr массой 0,2119 = 23,8 г, 0,1 моль KHSO3 массой 0,1120 = 12,0 г и 0,05 моль Ba(HSO3)2 массой 0,05299 = 14,95 г. Масса раствора равна m(р-ра) = m(р-ра BaBr2) + m(K2SO3) + m(SO2) – m(BaSO3) = 150 + 23,7 + 0,164 – 10,85 = 169,3 г. Массовые доли солей в растворе равны:
(KBr) = 23,8 / 169,3 = 0,141, или 14,1%;
(KHSO3) = 12,0 / 169,3 = 0,0709, или 7,09%;
(Ba(HSO3)2) = 14,95 / 169,3 = 0,0883, или 8,83%.
Ответ. 10,85 г осадка BaSO3; 14,1% KBr, 7,09% KHSO3, 8,83% Ba(HSO3)2.
7. По данным элементного анализа можно установить простейшую формулу углеводорода CxHy.
x : y = (96,43/12) : (3,57/1) = 2,251 = 9 : 4.
Простейшая формула — C9H4. Это — необычная формула. Нужно определить структуру этого соединения. Предположим, что простейшая формула совпадает с истинной. Согласно условию, углеводород содержит по крайней мере одну тройную связь на конце цепи, а всего тройных связей, судя по степени ненасыщенности, — четыре. Сколько из них концевых? От одной до четырех. Точно можно сказать только тогда, когда мы установим формулу соли. Возможные варианты строения исходного углеводорода, соответствующие разному числу концевых тройных связей:

В зависимости от количества этинильных групп CCH, на металл может заместиться от одного до четырех атомов водорода. Общая формула соли: C9H4–nMn, где n – число замещенных атомов водорода.
Согласно этой формуле, массовая доля металла равна (A — атомная масса металла):
0,7017 = nA / (912 + (4 – n) + nA),
откуда A = (112 – n) / (0,425n).
Перебором n от 1 до 4 убеждаемся, что возможны два решения:
1) n = 3, A = 85,4 (рубидий). Углеводород имеет три этинильные группы и описывается структурной формулой HCCCCCH(CCH)2. При действии амида рубидия должна образоваться соль RbCCCCCH(CCRb)2. Уравнения реакций:
HCCCCCH(CCH)2 + 3RbNH2 RbCCCCCH(CCRb)2 + 3NH3,
HCCCCCH(CCH)2 + 8H2 H3C(CH2)3CH(C2H5)CH2CH3.
2) n = 4, A = 63,5 (медь). Углеводород имеет четыре этинильные группы (его можно назвать тетраэтинилметан) и описывается структурной формулой C(CCH)4. При действии аммиачного раствора хлорида меди (I) должна образоваться соль C(CCCu)4. Уравнения реакций:
C(CCH)4 + 4[Cu(NH3)2]Cl C(CCCu)4 + 4NH3 + 4NH4Cl,
C(CCH)4 + 8H2 C(C2H5)4.
Ответ. 1) HCCCCCH(CCH)2 и C9HRb3; 2) C(CCH)4 и C9Cu4.
Решение варианта С-97-4
1.

При сгорании этого вещества образуются вода, H2O, CO2, N2 и HCl, а NO2 превращается в NO.
2C5H3NCl2 + 21NO2 = 10CO2 + 4HCl + N2 + H2O + 21NO
2 C5H3NCl2 – 21e 5C+4 + 3H+ + N0 + 2Cl–
21 N+4 + 2e N+2
2. Как известно, теплота реакции равна сумме теплот сгорания исходных веществ за вычетом суммы теплот сгорания продуктов реакции. Теплота реакции изомеризации
CH3CH(OH)CH3 <==> CH3CH2CH2OH
равна 1872 – 1887 = –15 кДж/моль. Это означает, что в этой реакции теплота поглощается; следовательно, пропанол-1 имеет бóльшую энергию и является «энергетически менее выгодным». Поэтому в равновесной смеси будет преобладать пропанол-2.
Относительные количества двух веществ можно оценить по разнице энергий:
(пропанол-1) / (пропанол-2) = exp[–E / RT] = = exp[–15000 / (8,31723)] = 0,082365.
Это значит, что в равновесной смеси пропанола-2 в 12 раз больше, чем его изомера.
3. Хром можно превратить в хлорид хрома (III) следующими способами:
1) реакцией с хлором:
2Cr + 3Cl2 = 2CrCl3;
2) растворением в соляной кислоте в присутствии воздуха:
4Cr + 12HCl + 3O2 = 4CrCl3 + 6H2O;
3) реакцией замещения в водном растворе:
2Cr + 3CuCl2 = 2CrCl3 + 3Cu;
4) реакцией с каким-либо хлорирующим реагентом, например SO2Cl2:
2Cr + 3SO2Cl2 = 2CrCl3 + 3SO2.
4. Формула вещества «А» C5H6N2 отличается от формулы пиридина C5H5N на группу NH (т.е. вместо атома H — аминогруппа NH2), поэтому предположим, что «А» — один из трех аминопиридинов, какой именно — станет ясно дальше. Проверим это предположение.
При действии ацетилхлорида CH3COCl происходит ацилирование аминогруппы, т.е. замена атома водорода на группу CH3CO с образованием соединения класса амидов, при этом образующийся хлороводород присоединяется к атому азота пиридинового кольца:

Гидрокарбонат калия отнимает у соединения «Б» хлороводород:

При действии бромной воды на соединение «А» два атома водорода (в орто- и пара-положениях по отношению к аминогруппе) замещаются на два атома брома, а образующиеся молекулы бромоводорода присоединяются к двум оснóвным атома азота. В результате последовательного протекания реакций замещения и присоединения к молекуле «А» присоединяются четыре атома брома:

Если бы аминогруппа в соединении «А» была в положении 3 по отношению к пиридиновому атому азота, то на бром заместилось бы три атома водорода (как в анилине). В то же время, 4-аминопиридин полностью удовлетворяет условию задачи и может служить соединением «А», поскольку в этом случае при бромировании замещается два атома водорода в орто-положениях по отношению к аминогруппе.
Гидроксид калия отнимает у молекулы «Г» две молекулы бромоводорода:

Наконец, при гидрировании молекула «А» присоединяет три молекулы водорода, и образуется производное пиперидина:

Ответ. «А» — 2-аминопиридин или 4-аминопиридин.
5. а) Если бы вместо альдегида в правой части был спирт, то легко догадаться, что это была бы реакция щелочного гидролиза сложного эфира. Однако, надо помнить, что спирты, содержащие группу OH при двойной связи, неустойчивы и изомеризуются в альдегиды и кетоны. Таким образом, данная реакция описывает щелочной гидролиз сложного эфира, образованного предельной кислотой и непредельным спиртом:
C2H5COOCH=CHCH3 + KOH C2H5COOK + + CH3CH2CH=O.
б) Один из способов получения альдегидов — гидролиз 1,1-дихлоралканов. Гидролиз можно проводить водой, щелочью, а можно и водным раствором карбоната калия:
CH3CH2CHCl2 + K2CO3 CH3CH2CH=O + 2KCl + CO2.
в) Данная реакция — окислительно-восстановительная. В качестве окислителя выступает любая натриевая соль кислородных кислот брома, например бромат, а восстановителем является нитрит натрия. Реакция протекает в подкисленном водном растворе.
NaNO2 + NaBrO = NaNO3 + NaBr.
г) В правой части находится кислая соль. Один из способов получения кислых солей — действие кислот на средние соли. Данная смесь солей может образоваться при неполном вытеснении сернистой кислоты из сульфита кальция соляной кислотой:
2CaSO3 + 2HCl = Ca(HSO3)2 + CaCl2.
6. Оба металлических компонента смеси — цинк и алюминий — реагируют как с серой, так и с соляной кислотой:
Zn + S = ZnS, (1)
2Al + 3S = Al2S3, (2)
Zn + 2HCl = ZnCl2 + H2, (3)
2Al + 6HCl = 2AlCl3 + 3H2. (4)
Сульфиды цинка и серы также растворимы в соляной кислоте:
ZnS + 2HCl = ZnCl2 + H2S, (5)
Al2S3 + 6HCl = 2AlCl3 + 3H2S. (6)
С раствором нитрата меди реагирует сероводород:
H2S + Cu(NO3)2 = CuS + 2HNO3.
(CuS) = 1,92 / 96 = 0,02 моль, (H2S) = (CuS) = 0,02 моль. Общее количество выделившегося газа (с учетом водорода) равно: (газов) = 0,784 /22,4 = 0,035 моль, следовательно в реакциях (3) и (4) выделилось 0,035–0,02 = 0,015 моль водорода.
Максимальное содержание веществ находится следующим образом. Представим себе, что в смеси почти не было алюминия, а были только цинк и сера. Тогда в реакцию (3) с соляной кислотой вступило 0,015 моль цинка. В реакцию (5) вступило 0,02 моль сульфида цинка, который образовался в реакции (1) из 0,02 моль цинка и 0,02 моль серы. Таким образом, в этом случае:
m(Zn) = (0,015 + 0,02) 65 = 2,28 г, m(S) = 0,02 64 = 1,28 г
(Zn) = 2,28 / (2,28 + 1,28) = 0,640 = 64,0%, (S) = 36,0%.
Аналогичный расчет можно провести в случае, когда в смеси почти не было цинка. В реакцию (4) вступило 0,01 моль алюминия, в реакцию (6) — 0,02/3 моль Al2S3, в реакцию (2) — 0,04/3 моль алюминия и 0,02 моль серы.
m(Al) = (0,01 + 0,04/3) 27 = 0,63 г, m(S) = 0,02 64 = 1,28 г
(Al) = 0,63 / (0,63 + 1,28) = 0,330 = 33,0%, (S) = 67,0%.
Таким образом, максимальное содержание серы в массовых процентах соответствует смеси с алюминием и пренебрежимо малым количеством цинка.
Ответ. 64,0% Zn, 33,0% Al, 67,0% S.
7. Водный раствор гидроксида калия реагирует с изопропилацетатом, но не реагирует с этанолом:
x x x
CH3COOC3H7 + KOH CH3COOK + C3H7OH.
(KOH) = 0,066 = 0,36 моль — избыток, поскольку количество изопропилацетата не может превысить 20,0 / 102 = 0,196 моль.
Пусть в исходном растворе (CH3COOC3H7) = x моль, тогда после выпаривания в смеси содержалось x моль CH3COOK и (0,36–x) моль KOH.
При прокаливании протекает реакция
CH3COOK + KOH CH4 + K2CO3.
Необходимо рассмотреть два случая:
1) KOH в последней реакции в избытке (0,36–x > x):
x x x
CH3COOK + KOH CH4 + K2CO3.
Тогда после прокаливании в смеси останется x моль K2CO3 и (0,36–2x) моль KOH. Массовая доля калия в смеси равна:
2x39 + (0,36–2x)39
= 0,587,
x138 + (0,36–2x)56
откуда x = 0,145 моль. Массовая доля изопропилацетата в исходном растворе равна 0,145102 / 20 = 0,739, а массовая доля спирта составляет: (CH3CH2OH) = 1 – 0,739 = 0,261.
2) KOH в последней реакции в недостатке (0,36–x < x):
0,36–x 0,36–x 0,36–x
CH3COOK + KOH CH4 + K2CO3.
Тогда после прокаливании в смеси останется (0,36–x) моль K2CO3 и (2x–0,36) моль CH3COOK. Массовая доля калия в смеси равна:
2(0,36–x)39 + (2x–0,36)39
= 0,593,
(0,36–x)138 + (2x–0,36)98
откуда x = 0,164 моль, что противоречит условию недостатка KOH. Этот вариант отпадает.
Ответ. (CH3CH2OH) = 0,261.
Решение варианта B-97-2
1. В состав дезоксирибонуклеозида входят остатки дезоксирибозы и одного из четырех азотистых оснований: аденина, гуанина, цитозина и тимина. Из этих оснований наименьшее число атомов азота (два) имеет тимин. Формула дезоксирибонуклеозида:

2. Многие слабые кислоты являются слабыми окислителями за счет кислого атома водорода H+ (исключения — кислоты, в которых анион является сильным окислителем: HClO, HClO2, HNO2). В качестве примера можно выбрать уксусную кислоту.
Кислотные свойства:
CH3COOH + NaOH = CH3COONa + H2O.
Окислительные свойства:
2CH3COOH + Mg = (CH3COO)2Mg + H2.
3. а) Для окисления альдегида в кислоту можно использовать сернокислый раствор перманганата или дихромата калия:
5C2H5CHO + 2KMnO4 + 3H2SO4 = 5C2H5COOH + K2SO4 + 2MnSO4 + 3H2O.
б) Из реактива Гриньяра карбоновые получают реакцией присоединения к CO2 с последующим гидролизом:
C2H5MgBr + CO2 + H2O C2H5COOH + Mg(OH)Br.
4. а) Кальций получают электролизом расплава хлорида. Нитрат кальция можно превратить в хлорид в две стадии. При сильном прокаливании нитрат разлагается до оксида:
2Ca(NO3)2 = 2CaO + 4NO2 + O2,
который затем растворяют в соляной кислоте:
CaO + 2HCl = CaCl2 + H2O.
При электролизе расплава хлорида кальция образуются простые вещества:
CaCl2 = Ca + Cl2.
б) Ртуть образуется при прокаливании нитрата ртути:
Hg(NO3)2 = Hg + 2NO2 + O2.
в) Сильное нагревание нитрата железа (II) дает оксид железа (III), который превращается в железо при нагревании с углем:
4Fe(NO3)2 = 2Fe2O3 + 8NO2 + O2,
Fe2O3 + 3C = 2Fe + 3CO.
5. Исходное вещество C8H10 принадлежит гомологическому ряду ароматических углеводородов и представляет собой этилбензол или один из диметилбензолов. Первая реакция — нитрование в бензольное кольцо. Во второй реакции один атом водорода замещается на атом хлора. Где происходит замещение — в кольце или в боковой цепи — становится понятным из третьей реакции. В этой реакции отщепляется молекула HCl, что возможно только в случае, если атом хлора был в боковой цепи, содержащей два атома углерода. Таким образом, исходное вещество — этилбензол. Наличие боковой цепи с двумя атомами углерода подтверждается также четвертой реакцией, в которой происходит окисление с уменьшением числа углеродных атомов. Уравнения реакций:




6. Пусть атомная масса неизвестного металла равна X г/моль, тогда количество сульфида равно (MeS) = 1,76 / (X + 32). Для краткости обозначим это количество через b. В результате обжига b моль сульфида MeS в избытке кислорода по уравнению
b b/2
4MeS + 7O2 = 2Me2O3 + 4SO2
образовалось b/2 моль оксида Me2O3, для растворения которых по уравнению
b/2 3b/2 b/2
Me2O3 + 3H2SO4 = Me2(SO4)3 + 3H2O
потребовалось 3b/2 моль H2SO4. Масса 29,4%-ного раствора H2SO4 составляет (3b/2)98 / 0,294 = 500b г. Общая масса раствора равна: m(р-ра) = m(Me2O3) + m(р-ра H2SO4) = b/2 (2X + 48) + 500b = (X + 524)b г.
Масса соли в растворе равна: m(Me2(SO4)3) = b/2 (2X + 288) = (X + 144)b г. По условию, массовая доля Me2(SO4)3 составляет 34,5% :
(X + 144)b = 0,345 (X + 524)b,
откуда X = 56 (b = 0,02). Исходный сульфид — FeS, в растворе содержится Fe2(SO4)3 массой (X + 144)b = 200 0,02 = 4,0 г. Исходная масса раствора (до охлаждения) равна (X + 524)b = 580 0,02 = 11,6 г.
При охлаждении этого раствора выпало 2,9 г кристаллогидрата, следовательно, общая масса раствора стала равна 11,6 – 2,9 = 8,7 г. Масса Fe2(SO4)3 в оставшемся растворе равна 8,7 0,23 = 2,0 г; в выпавших кристаллах содержится 4,0 – 2,0 = 2,0 г Fe2(SO4)3, что соответствует 2,0 / 400 = 0,005 моль. Масса воды в кристаллах равна 2,9 – 2,0 = 0,9 г, что соответствует 0,9 / 18 = 0,05 моль. Количество воды в кристаллах в 10 раз превосходит количество соли, следовательно формула кристаллогидрата — Fe2(SO4)310H2O.
Ответ. Fe2(SO4)310H2O.
7. Естественная переменная для этой задачи — число атомов углерода, n. Как следует из продуктов гидратации, в состав исходной смеси входили алкен CnH2n и алкин CnH2n–2, причем алкена было в два раза больше: (CnH2n) = 2(CnH2n–2). Запишем уравнения гидратации в молекулярном виде:
CnH2n + H2O = CnH2n+1OH,
CnH2n–2 + H2O = CnH2nO.
Возьмем два моль алкена и один моль алкина. В результате сгорания этой смеси по уравнениям
2 2n 2n
CnH2n + 3n/2 O2 = nCO2 + nH2O
1 n n–1
CnH2n–2 + (3n–1)/2 O2 = nCO2 + (n–1)H2O
образуются углекислый газ в количестве (CO2) = 2n + n = 3n и вода в количестве (H2O) = 2n + (n–1) = (3n–1). Общая масса продуктов сгорания равна
m(прод.) = m(CO2) + m(H2O) = 3n44 + (3n–1)18 = (186n – 18) г.
Пары воды поглощаются сульфатом меди:
CuSO4 + 5H2O = CuSO45H2O.
По условию, масса воды 27,27% от массы исходной смеси:
(3n–1) 18 = 0,2727 (186n – 18),
откуда n = 4.
Единственный алкин состава C4H6, который дает осадок с [Ag(NH3)2]OH, — бутин-1:
C2H5CCH + [Ag(NH3)2]OH C2H5CCAg + 2NH3 + H2O.
Этот углеводород имеет неразветвленный углеродный скелет, следовательно у алкена — разветвленный скелет. Существует единственный алкен состава C4H8 с разветвленным скелетом — 2-метилпропен.

Уравнения реакций гидратации:


Ответ. 2-метилпропен, бутин-1.
Решение варианта M-97-1
1.
![]()
Лактат кальция растворим в воде и может вступать в обменные реакции с образованием малорастворимых солей кальция, например:
(CH3CH(OH)COO)2Ca + K2CO3 = CaCO3 + + 2CH3CH(OH)COOK.
Молочная кислота — слабая, поэтому сильные минеральные кислоты вытесняют ее из лактатов:
(CH3CH(OH)COO)2Ca + 2HCl = CaCl2 + 2CH3CH(OH)COOH.
2. В водном растворе аммиака устанавливается равновесие:
![]()
Константа этого равновесия имеет вид:

(концентрация воды практически не изменяется в результате этой реакции и не входит в константу равновесия).
Пусть равновесная концентрация [OH–] = x моль/л, тогда [NH4+] = x, [NH3] = 1,5–x. Подставляя эти значения в выражение для константы равновесия и решая квадратное уравнение, находим: x = 5,010–3. Концентрацию ионов водорода можно найти через ионное произведение воды:
[H+] = Kw / [OH–] = 1,010–14 / 5,010–3 = 2,010–12 моль/л.
Ответ. [H+] = 2,010–12 моль/л.
3. Уравнение реакции:
5SO2 + 2KMnO4 + 2H2O = K2SO4 + 2MnSO4 + 2H2SO4.
Согласно этому уравнению, на 2 моль H2SO4 (масса 298 = 196 г) образуется 1 моль K2SO4 (масса 174 г) и 2 моль MnSO4 (масса 2151 = 302 г). Поскольку все эти вещества находятся в одном растворе (т.е., масса раствора для них одинакова), то отношение их массовых долей равно отношению масс:
(K2SO4) / (H2SO4) = m(K2SO4) / m(H2SO4) = 174 / 196,
откуда (K2SO4) = 0,050174 / 196 = 0,044, или 4,4%. Аналогично, (MnSO4) = 0,050302 / 196 = 0,077, или 7,7%.
Ответ. (K2SO4) = 4,4%, (MnSO4) = 7,7%.
4. 1) Наличие ацетальдегида можно доказать реакцией с избытком аммиачного раствора оксида серебра:
CH3CHO + 2[Ag(NH3)2OH] = 2Ag + CH3COONH4 + + 3NH3 + H2O.
Избыток реактива берется потому, что уксусная кислота также реагирует с [Ag(NH3)2OH], правда без выделения осадка:
3CH3COOH + [Ag(NH3)2OH] = CH3COOAg + + 2CH3COONH4 + H2O.
2) Качественная реакция на уксусную кислоту — выделение газа при действии гидрокарбоната натрия:
CH3COOH + NaHCO3 = CH3COONa + CO2 + H2O.
3) Фенол дает белый осадок при обработке бромной водой:

При избытке бромной воды 2,4,6-трибромфенол переходит в следующее соединение:

5. 1) Хлорат бария образуется при пропускании хлора через горячий раствор Ba(OH)2:
6Ba(OH)2 + 6Cl2 = 5BaCl2 + Ba(ClO3)2 + 6H2O.
2) Ba(ClO3)2 + H2SO4 = BaSO4 + 2HClO3.
3) HClO3 + KOH = KClO3 + H2O.
4) Хлорат калия — сильный окислитель; он окисляет соляную кислоту до хлора:
KClO3 + 6HCl = KCl + 3Cl2 + 3H2O.
5) Гипохлорит бария — сильный окислитель, легко восстанавливается до хлорида:
Ba(OCl)2 + 2KNO2 = BaCl2 + 2KNO3.
6) 2HCl + Ba(OH)2 = BaCl2 + 2H2O.
7) KCl + H2SO4(конц) = KHSO4 + HCl.
8) Гипохлорит бария можно превратить в хлорид калия путем восстановления до хлорида с одновременным протеканием обменной реакции:
Ba(OCl)2 + 2K2SO3 = BaSO4 + K2SO4 + 2KCl.
9) Гипохлорит бария образуется при пропускании хлора через холодный раствор Ba(OH)2:
2Ba(OH)2 + 2Cl2 = BaCl2 + Ba(OCl)2 + 2H2O.
10) Хлорат бария при сильном нагревании разлагается до хлорида:
Ba(ClO3)2 = BaCl2 + 3O2.
11) Соляная кислота образуется при восстановлении хлорноватой кислоты:
4HClO3 + 3H2S = 4HCl + 3H2SO4.
12) Хлорат калия при сильном нагревании разлагается до хлорида:
2KClO3 = 2KCl + 3O2.
6. Одновалентный металл — это либо щелочной металл, либо серебро. В случае щелочных металлов (кроме лития) реакция разложения описывается уравнением:
2MeNO3 = 2MeNO2 + O2.
Отношение масс твердого продукта и исходного нитрата равно (X — атомная масса металла):
(X + 46) / (X + 62) = 0,635,
откуда X = –18,2 г/моль, что не имеет смысла.
Нитрат серебра разлагается по уравнению:
2AgNO3 = 2Ag + 2NO2 + O2.
В этом случае отношение масс твердого продукта и исходного нитрата равно 108 / 170 = 0,635, что удовлетворяет условию задачи.
Ответ. AgNO3.
7. Эту задачу удобно решать методом ретросинтеза, т.е. с конца. Уреид 2-бром-2-этилбутановой кислоты (C2H5)2CBrCONHCONH2 можно получить ацилированием мочевины (NH2)2CO по схеме:
–HCl
(C2H5)2CBrCONHCONH2 (C2H5)2CBrCOCl + + NH2CONH2.
Хлорангидрид (C2H5)2CBrCOCl образуется из соответствующей кислоты:
–POCl3
(C2H5)2CBrCOCl (C2H5)2CBrCOOH + PCl5.
-Бромзамещенная кислота (C2H5)2CBrCOOH получается при бромировании 2-этилбутановой кислоты в присутствии катализатора — красного фосфора:
–HBr
(C2H5)2CBrCOOH (C2H5)2CHCOOH + Br2.
Осталось получить 2-этилбутановую кислоту из пентанона-3. Это можно сделать по следующей схеме:

Решение варианта 21
1. Кислород не реагирует с оксидом азота (IV), тогда как озон окисляет его до оксида азота (V):
2NO2 + O3 = N2O5 + O2.
2.

3. Например,

4 . а) 5Na2SO3 + 2KMnO4 + 3H2SO4 5Na2SO4 + 2MnSO4 + K2SO4 + 3H2O.
5 SO32- + H2O – 2e SO42- + 2H+
2 MnO4- + 8H+ + 5e Mn2+ + 4H2O
б) Из продуктов предыдущей реакции только сульфат марганца (вещество Х) реагирует со щелочью:
MnSO4 + 2KOH = Mn(OH)2 + K2SO4.
5. Общая формула кристаллогидрата ацетата свинца:
(CH3COO)2PbxH2O.
В данной порции кристаллогидрата содержится 1,4451024 / 6,021023 = 2,4 моль атомов углерода. Это означает, что всего было дано 2,4/4 = 0,6 моль кристаллогидрата, в котором содержится водорода
(H) = 0,6 (6 + 2x) = 8,6991024 / 6,021023 = 14,4,
откуда x = 9. В 0,6 моль кристаллогидрата состава (CH3COO)2Pb9H2O содержится 0,6(4+9) = 7,8 моль атомов кислорода. Число атомов кислорода равно 7,86,021023 = 4,701024.
Ответ. 4,701024 атомов кислорода.
6. Желтое окрашивание пептидов под действием азотной кислоты (ксантопротеиновая реакция) — это качественная реакция на остатки ароматических аминокислот — фенилаланина или тирозина.
По условию, дипептид образован из двух остатков одной и той же аминокислоты. Уравнение гидролиза можно записать в следующем виде:

Разница масс аминокислоты и дипептида — это масса воды, вступившей в реакцию: m(H2O) = 3,30 – 3,12 = 0,18 г.
(H2O) = 0,18 / 18 = 0,01 моль = (дипептида).
M(дипептида) = 3,12 / 0,01 = 312 г/моль, откуда
M(R) = [312 – M(H2NCHCONHCHCOOH)] / 2 = 91 г/моль. Из двух ароматических аминокислот последнему условию удовлетворяет фенилаланин (R = CH2C6H5):

Ответ. Фенилаланил-фенилаланин.
7. X — H2O, A — NaOH, B — NaHCO3, C — CH3OH. Уравнения реакций:
1) 2Na + 2H2O = 2NaOH + H2;
2) NaOH + CO2 = NaHCO3;
3) 2NaHCO3 = Na2CO3 + H2O + CO2 (при нагревании);
4) CH3COOCH3 + H2O = CH3OH + CH3COOH;
t, H2SO4
5) 2CH3OH CH3OCH3 + H2O;
6) (CH3CO)2O + H2O = 2CH3COOH.
8. Составу C4H8O2 отвечают бутановая (масляная) кислота C3H7COOH и сложные эфиры C2H5COOСH3, CH3COOС2H5, HCOOС3H7 (2 эфира). Формула C2H4O описывает, вероятнее всего, уксусный альдегид, который можно получить из этилацетата (этилового эфира уксусной кислоты) по следующей схеме:
1) CH3COOС2H5 + NaOH = CH3COONa + C2H5OH.
2) C2H5OH + CuO CH3CH=O + Cu + H2O.
Ответ. Этилацетат.
9. 1) FeCl3 + 3NH3 + 3H2O = Fe(OH)3 + 3NH4Cl;
2) Fe(OH)3 + 3HBr = FeBr3 + 3H2O.
10. Пусть в исходной смеси содержится по одному молю Me(OH)2 и MeCO3. При прокаливании протекают реакции:
t
Me(OH)2 MeO + H2O.
t
MeCO3 MeO + CO2.
Твердый остаток — это два моля MeO массой 2(A+16) г, где A — атомная масса неизвестного металла. Газообразный продукт при 15 оС — CO2 (один моль массой 44 г). По условию задачи,
2(A+16) = 3,27344,
откуда A = 56 г/моль. Неизвестный металл — железо.
К двум молям FeO массой 272 = 144 г добавили соляную кислоту массой 14415 = 2160 г:
1,08 2,16 1,08
FeO + 2HCl = FeCl2 + H2O.
(HCl) = 21600,0365 / 36,5 = 2,16 моль. HCl находится в недостатке, поэтому в соляной кислоте растворится только 2,16/2 = 1,08 моль FeO, и образуется 1,08 моль FeCl2.
m(р-ра) = m(р-ра HCl) + m(FeO) = 2160 + 1,0872 = 2238 г.
m(FeCl2) = 1,08127 = 137,2 г.
(FeCl2) = 137,2 / 2238 = 0,0613 = 6,13%.
Ответ. 6,13% FeCl2.
Решение варианта 23
1. Na2CO3 + 2H3PO4 = 2NaH2PO4 + CO2 + H2O.
2. Глюкоза — это альдегидоспирт. Альдегидная группа глюкозы CH=O может быть окислена до карбоксильной группы COOH, а может быть восстановлена до группы CH2OH.
3. В молекуле бутадиена-1,3 CH2=CHCH=CH2 все четыре атома углерода находятся в состоянии sp2-гибридизации.
4 . а) 2KNO2 + 2KI + 2H2SO4 = I2 + 2NO + 2K2SO4 + 2H2O.
2 NO2- + 2H+ + e = NO + H2O
1 2I- – 2e = I2
б) Из всех продуктов первой реакции только NO (вещество X) реагирует с кислородом:
2NO + O2 = 2NO2.
5. Пусть в исходной смеси содержится x моль NO2 и y моль Ne, тогда x + y = 0,896 / 22,4 = 0,04.
Молекула NO2 содержит 23 электрона (7 в атоме азота и 16 — в двух атомах кислорода), а атом Ne — 10 электронов. Общее количество электронов в смеси составляет
(e) = 23x + 10y = 3,191023 / 6,021023 = 0,53.
Решая систему двух линейных уравнений с двумя неизвестными, находим x = 0,01, y = 0,03. Объемные доли газов равны:
(NO2) = 0,01 / 0,04 = 0,25 = 25%, (Ne) = 0,03 / 0,04 = 0,75 = 75%.
Ответ. 25% NO2, 75% Ne.
6. Лизин реагирует с гидроксидом натрия:

В полученном растворе содержится по 0,1 моль лизина и его натриевой соли. Молекула лизина может реагировать с двумя молекулами хлороводорода:

а молекула натриевой соли лизина — с тремя молекулами.

В конечном растворе содержится 0,2 моль хлороводородной соли лизина массой 0,2219 = 43,8 г, 0,1 моль хлорида натрия массой 0,158,5 = 5,85 г и (0,7–0,3–0,2) = 0,2 моль хлороводорода. Вода и хлороводород улетучиваются при выпаривании раствора. Масса твердого остатка равна 43,8 + 5,85 = 49,65 г.
Ответ. 49,65 г.
7. X — CH3CHO, A — H2, B — H2O, C — CO2, D — C. Уравнения реакций:
Ni, t
CH3CHO + H2 C2H5OH;
CH3CHO + 2Cu(OH)2 = CH3COOH + Cu2O + 2H2O;
2CH3COOH + Mg = (CH3COO)2Mg + H2;
«A»
2H2 + O2 = 2H2O;
«B»
C2H5OH + 3O2 = 2CO2 + 3H2O;
«C»
t
CO2 + 2Mg C + 2MgO;
«D»
8. Составу C4H8O и условиям задачи отвечает бутановый (масляный) альдегид. Из этого альдегида можно получить спирт и кислоту, которые в реакции между собой дадут сложный эфир:
Ni, t
C3H7CHO + H2 C3H7CH2OH;
C3H7CHO + 2Cu(OH)2 = C3H7COOH + Cu2O + 2H2O;
H+, t
C3H7COOH + HOCH2C3H7 <===> C3H7COOCH2C3H7 + H2O.
Ответ. Бутановый альдегид.
9. 1) NH4NO2 N2 + 2H2O (нагревание);
2) MgCO3 CO2 + MgO (нагревание);
3) N2 + 3H2 2NH3 (нагревание под давлением в присутствии катализатора);
4) CO2 + NH3 + H2O NH4HCO3 (пропускание избытка углекислого газа через водный раствор аммиака).
10. Пусть масса исходного раствора равна 100 г, тогда m(FeCl3) = 15 г, (FeCl3) = 15 / 162,5 = 0,0923 моль. При добавлении к этому раствору карбоната калия происходит взаимный гидролиз:
x 1,5x x 1,5x 3x
2FeCl3 + 3K2CO3 + 3H2O = 2Fe(OH)3 + 3CO2 + 6KCl.
Пусть в эту реакцию вступило x моль хлорида железа (III), тогда в полученном растворе m(FeCl3) = 15 – 162,5x. Масса раствора равна: m(р-ра) = 100 + m(K2CO3) – m(Fe(OH)3) – m(CO2) = 100 + 1,5x138 – 1,5x44 – x107 = 100 + 34x.
По условию, массовая доля хлорида железа в новом растворе равна 5%:
(FeCl3) = (15 – 162,5x) / (100 + 34x) = 0,05,
откуда x = 0,0609. Массовая доля KCl равна:
(KCl) = 30,060974,5 / (100 + 340,0609) = 0,133.
Ответ. 5,00% FeCl3, 13,3% KCl.
Решение варианта 25
1. NaHCO3 — гидрокарбонат натрия («питьевая сода»);
Na2CO3 —карбонат натрия («техническая сода»).
2. CH2OH(CHOH)3COCH2OH — фруктоза.
3. Только насыщенные углеводороды (алканы и циклоалканы) не содержат -связей. Алканы общей формулы CnH2n+2 содержат (3n+1) -связей (2n+2 связей CH и n–1 связей CС). Уравнение 3n+1 = 15 не имеет целочисленного решения, поэтому искомый углеводород — не алкан.
Циклоалканы общей формулы CnH2n содержат 3n -связей (2n связей CH и n связей CС). Уравнение 3n = 15 имеет решение n = 5. Искомый углеводород — циклопентан.
Ответ. Циклопентан.
4 . а) H2O2 + 2FeSO4 + H2SO4 = Fe2(SO4)3 + 2H2O.
1 H2O2 + 2H+ + 2e = 2H2O
2 Fe2+ – e = Fe3+
б) Из продуктов первой реакции только H2O (вещество X) реагирует с оксидом серы (VI):
SO3 + H2O = H2SO4.
5. Если плотности газовых смесей, находящихся при одинаковых условиях, равны, то равны их средние молярные массы: M1 = M2.
Средняя молярная масса первой смеси больше молярной массы неона, но меньше молярной массы хлороводорода:
20 < M1 < 36,5.
Аналогично, средняя молярная масса второй смеси больше молярной массы сероводорода, но меньше молярной массы пропана:
34 < M2 < 44.
Поскольку M1 = M2, то M1 также должна быть больше молярной массы сероводорода:
34 < M1 < 36,5.
Среднюю молярную массу первой смеси можно выразить через объемную долю неона следующим образом:
M1 = M(Ne)(Ne) + M(HCl)[1–(Ne)] = 36,5 – 16,5(Ne).
Подставляя это выражение в последнее неравенство, находим:
0 < (Ne) < 2,5/16,5 = 0,152.
Ответ. 0 < (Ne) < 0,152.
6. Пусть в исходной смеси содержалось x моль пирокатехина C6H4(OH)2 (M = 110 г/моль) и y моль сложных эфиров CH3COOCH3 и HCOOC2H5, являющихся изомерами (M = 74 г/моль), тогда масса смеси равна: 110x + 74y = 2,94 г.
Со щелочью реагируют все три вещества:
C6H4(OH)2 + 2NaOH = C6H4(ONa)2 + 2H2O;
CH3COOCH3 + NaOH = CH3COONa + CH3OH;
HCOOC2H5 + NaOH = HCOONa + C2H5OH.
В первую реакцию вступает 2x моль NaOH, во вторую и третью — суммарно y моль NaOH, всего 2x + y = 0,05.
Решая систему двух уравнений для x и y, находим: x = 0,02.
(пирокатехина) = 0,02110 / 2,94 = 0,748 = 74,8%.
Ответ. 74,8% пирокатехина.
7. 2CH3OH + 2Na = 2CH3ONa + H2;
«A» — простое вещество
H2 + S = H2S;
«B» — кислота
H2S + NaOH = NaHS + H2O;
«C» — кислая соль
2CH3OH + 3O2 = 2CO2 + 4H2O;
«D» — оксид
H2O + CaO = Ca(OH)2;
«E» — гидроксид
Ca(OH)2 + CO2 = CaCO3 + H2O.
«F» — средняя соль
8. Составу C6H12O3N2 и условиям задачи отвечает дипептид, образованный двумя остатками аланина. C3H6NO2K — калиевая соль аланина, которую можно получить из дипептида в одну стадию путем щелочного гидролиза:

Эту же реакцию можно провести в две стадии: сначала гидролиз в кислой среде, а затем — нейтрализация аминокислоты щелочью.
Ответ. Аланил-аланин.
9. 1) CaH2 + 2H2O = Ca(OH)2 + 2H2;
2) [CuOH]2CO3 2CuO + CO2 + H2O (нагревание);
3) CuO + H2 Cu + H2O (пропускание водорода над раскаленной медью).
10. При добавлении сильных кислот к раствору Na[Cr(OH)4] сначала происходит частичная нейтрализация, и выпадает осадок Cr(OH)3, который затем растворяется в избытке кислоты (полная нейтрализация). Образование осадка под действием смеси азотной и соляной кислот описывается сокращенным ионным уравнением:
0,0009 0,0009 0,0009
[Cr(OH)4]- + H+ = Cr(OH)3 + H2O.
([Cr(OH)4]-) = 0,060,015 = 0,0009 моль. Максимальная масса осадка образуется, когда количество ионов H+ соответствует этому уравнению. Таким образом, в 6 мл раствора смеси кислот содержится 0,0009 моль ионов H+.
При последующем добавлении кислоты осадок растворяется в соответствии с ионным уравнением:
0,0003 0,0009
Cr(OH)3 + 3H+ = Cr3+ + 3H2O.
При добавлении 6 мл раствора кислот, в котором содержится 0,0009 моль ионов H+, растворится часть осадка, а именно 0,0009/3 = 0,0003 моль. Масса оставшегося осадка равна (0,0009–0,0003)103 = 0,0618 г.
Ответ. 0,0618 г Cr(OH)3.
Решение варианта 27
1. Литий сгорает в кислороде с образованием оксида:
4Li + O2 = 2Li2O.
Натрий в этих же условиях превращается в пероксид:
2Na + O2 = Na2O2.
2. Третичная структура белка обеспечивается взаимодействием полярных и неполярных заместителей в различных местах цепи. Наиболее распространенная форма сшивания между цепями — образование дисульфидных мостиков SS между двумя цистеиновыми остатками.
3. Среди перечисленных веществ уже есть одна пара гомологов — эфиры молочной кислоты:

Остались молочная кислота и акриловая кислота. Нужно добавить по одному гомологу каждого из этих веществ:

4 . а) H2S + 2FeCl3 = 2FeCl2 + S + 2HCl.
1 H2S – 2e = S + 2H+
2 Fe3+ + e = Fe2+
б) Все три продукта реакции а) могут реагировать с магнием. Нагревание необходимо только для реакции с серой (вещество X):
Mg + S = MgS.
5. Возьмем один моль смеси. Пусть (CaC2) = x, тогда (CaCO3) = 1–x. Количество углерода в смеси составляет (C) = 2x + (1–x) = 1+x, а его масса равна m(C) = 12(1+x) г. Общая масса смеси равна
m(смеси) = m(CaC2) + m(CaCO3) = 64x + 100(1–x) = 100 – 36x.
По условию массовая доля углерода в смеси составляет 25%:
(C) = m(C) / m(смеси) = 12(1+x) / (100 – 36x) = 0,25,
откуда x = 13/21. Молярное соотношение веществ в смеси равно:
(CaC2) / (CaCO3) = x / (1–x) = 13/8.
Ответ. (CaC2) / (CaCO3) = 13/8.
6. Обозначим гомолог фенола ROH, а изомерный ему ароматический спирт — R’OH. Из этих двух веществ только гомолог фенола может реагировать с гидроксидом натрия:
0,02 0,02
ROH + NaOH = RONa + H2O.
(NaOH) = 0,00210 = 0,02 моль, (ROH) = 0,02 моль.
С натрием могут реагировать оба изомера — и гомолог фенола, и ароматический спирт:
0,02 0,01
ROH + Na = RONa + 1/2H2.
0,03 0,015
R’OH + Na = R’ONa + 1/2H2.
(H2) = 0,56 / 22,4 = 0,025 моль. В первой реакции образуется 0,02/2 = 0,01 моль H2, а во второй — (0,025–0,01) = 0,015 моль. Следовательно, ароматического спирта было в два раза больше, чем водорода во второй реакции: (R’OH) = 0,03 моль.
Поскольку ROH и R’OH — изомеры, их массовые доли в смеси равны мольным долям:
(ROH) = 0,2 / (0,2+0,3) = 0,4; (R’OH) = 1 – 0,4 = 0,6.
Ответ. 40% гомолога фенола, 60% ароматического спирта.
7. 3HOCH2CH2OH + 8KMnO4 3KOOCCOOK + 8MnO2 + 2KOH + 8H2O;
«A»
CH2=CHCH2Cl + KOH CH2=CHCH2OH + KCl;
«B»
CH2=CHCH2OH + Na CH2=CHCH2ONa + 1/2H2;
«C»
CH3CH=O + H2 CH3CH2OH;
«D»
CH3CH2OH + 3O2 2CO2 + 3H2O;
«E»
(CH3CO)2O + H2O 2CH3COOH.
8. Искомый изомер — линолевая кислота C17H31COOH (кислота с двумя двойными связями в углеродной цепи). Уравнения реакций:
1) C17H31COOH + 2H2 = C17H35COOH (нагревание в присутствии никелевого катализатора);
2) 2С17H35COOH + Ba(OH)2 = (C17H35COO)2Ba + 2H2O.
9. Условию задачи удовлетворяет реакция восстановления оксида железа (III) аммиаком при нагревании:
Fe2O3 + 2NH3 = 2Fe + N2 + 3H2O.
 1
2N-3
– 6e
= N2
1
2N-3
– 6e
= N2
2 Fe3+ + 3e = Fe0
10. Возьмем 100 г раствора азотной кислоты, тогда m(HNO3) = 10 г, (HNO3) = 100 / 63 = 0,159 моль. Растворение основного карбоната меди в азотной кислоте описывается уравнением:
0,0397 0,159 0,0794 0,0397
[CuOH]2CO3 + 4HNO3 = 2Cu(NO3)2 + CO2 + 3H2O.
В азотной кислоте растворится 0,159/4 = 0,0397 моль [CuOH]2CO3 массой 0,0397222 = 8,81 г, при этом образуется 0,159/2 = 0,0794 моль Cu(NO3)2 массой 0,0794188 = 14,9 г, и выделяется 0,159/4 = 0,0397 моль CO2 массой 0,039744 = 1,75 г. Масса раствора после реакции равна:
m(р-ра) = 100 + m([CuOH]2CO3) – m(CO2) = 107,1 г.
Массовая доля нитрата меди равна:
(Cu(NO3)2) = 14,9 / 107,1 = 0,139 = 13,9%.
Ответ. 13,9% Cu(NO3)2.
Решение варианта 29
1. Легче всего выделить в свободном состоянии I2, например:
2KI + Br2 = 2KBr + I2.
Труднее всего получить фтор. Единственный способ получения фтора — электролиз плавиковой кислоты в присутствии фторида калия:
2HF = H2 + F2.
2. При нагревании формальдегида с гидроксидом кальция А.М.Бутлеров получил смесь сахароподобных веществ. Примерное уравнение реакции:
OH-
6CH2O C6H12O6.
3.
4. а) 2(NH4)2HPO4 + 3Ba(OH)2 = Ba3(PO4)2 + 4NH3 + 6H2O.
б) С разбавленной серной кислотой реагирует аммиак (вещество X):
2NH3 + H2SO4 = (NH4)2SO4.
5. Пусть (CO2) = x, (H2CO) = y, тогда x + y = 22,4 / 22,4 = 1 моль. Смесь имеет одинаковую плотность с хлороводородом, поэтому ее средняя молярная масса равна молярной массе хлороводорода:
Mср(CO2,H2CO) = (44x + 30y) / (x + y) = 36,5 г/моль.
Решая систему двух уравнений для x и y, находим: x = 0,464, y = 0,536. Количество кислорода в смеси составляет (O) = 2x + y = 20,464 + 0,536 = 1,464, а число атомов кислорода равно N(O) = 1,4646,021023 = 8,811023.
Ответ. N(O) = 8,811023.
6. При обработке дибромпропана спиртовым раствором щелочи выделяется пропин:
0,02 0,04 C2H5OH 0,04
CH2BrCHBrCH3 + 2KOH CH3CCH + 2KBr + 2H2O.
(CH2BrCHBrCH3) = 4,04 / 202 = 0,02 моль, (KOH) = 200,2 / 56 = 0,071 моль — избыток. После окончания реакции и выпаривания раствора в смеси останутся (0,071–0,04) = 0,031 моль KOH и 0,04 моль KBr. Масса смеси равна 0,03156 + 0,04119 = 6,50 г.
Ответ. 6,50 г.
7. 2NaOH + Zn + 2H2O = Na2[Zn(OH)4] + H2;
«A»
H2 + Cl2 = 2HCl;
«B»
HCl + NaOH = NaCl + H2O;
«C» — оксид
H2O + Na2O = 2NaOH;
H2O + (CH3CO)2O = 2CH3COOH;
2CH3COOH + Mg = (CH3COO)2Mg + H2.
«A»
8. Искомый изомер — стирол (винилбензол). Уравнения реакций:
9. При термическом разложении перманганата калия получается кислород:
2KMnO4 = K2MnO4 + MnO2 + O2.
Фосфин сгорает в атмосфере кислорода с образованием фосфорной кислоты:
PH3 + 2O2 = H3PO4.
Для получения дигидрофосфата натрия к фосфорной кислоте надо добавить равное количество гидроксида натрия:
H3PO4 + NaOH = NaH2PO4 + H2O.
10. Максимальная масса осадка образуется, когда щелочи добавлено ровно столько, сколько нужно для образования гидроксидов алюминия и железа:
0,1 0,2
Al2(SO4)3 + 6KOH = 2Al(OH)3 + 3K2SO4,
FeClx + xKOH = Fe(OH)x + xKCl.
При дальнейшем добавлении щелочи Al(OH)3 растворится:
Al(OH)3 + KOH = K[Al(OH)4].
Из условия задачи следует, что 4,50 г — это масса Fe(OH)x, а (20,1–4,5) = 15,6 г — масса Al(OH)3.
(Al(OH)3) = 15,6 / 78 = 0,2 моль,
(Al2(SO4)3) = (Al(OH)3) / 2 = 0,1 моль,
m(Al2(SO4)3) = 0,1342 = 34,2 г,
m(FeClx) = 40,55 – 34,2 = 6,35 г.
Из уравнения реакции следует, что количество хлорида железа равно количеству гидроксида железа:
(FeClx) = 6,35 / (56+35,5x) = (Fe(OH)x) = 4,50 / (56+17x),
откуда x = 2.
Ответ. FeCl2.
Рекомендуемая литература:
1. Кузьменко Н.Е., Еремин В.В., Попков В.А. Начала химии. Современный курс для поступающих в вузы. В 2-х т. — М.: 1-я Федерат. Книготорг. компания, 1997.
2. Кузьменко Н.Е., Еремин В.В., Попков В.А. Химия для школьников старших классов и поступающих в вузы. — М.: Дрофа, 1995.
3. Еремин В.В., Кузьменко Н.Е., Попков В.А. Конкурсные задачи по химии (пособие для абитуриентов). — М.: Принт-Ателье, 1995.
4. Фельдман Ф.Г., Рудзитис Г.Е. Химия: Учебники для 8-11 классов средней школы. М.: Просвещение, 1989-1994.
5. Цветков Л.А. Органическая химия: Учебник для 10 класса средней школы. 25-е изд. М.: Просвещение, 1988.
6. Химия: Справочные материалы / Под ред. Ю.Д.Третьякова. 1-3-е изд. — М.: Просвещение, 1984, 1988, 1993.
7. Еремина Е.А., Еремин В.В., Кузьменко Н.Е. Справочник школьника по химии (8-11 классы). 3-е изд. — М.: Дрофа, 1997.
8. Еремин В.В., Кузьменко Н.Е. Химия, ответы на вопросы: теория и примеры решения задач. — М.: 1-я Федерат. Книготорг. компания, 1997.
9. Конкурсный экзамен по химии. МГУ-96. — М.: Химический факультет МГУ, 1996.
10. Хомченко Г.П. Химия для поступающих в вузы. — М.: Высшая школа, 1988, 1993.
11. Фримантл М. Химия в действии. В 2-х ч. — М.: Мир, 1991.
12. Ахметов Н.С. Неорганическая химия. В 2-х ч. 3-е изд. — М.: Просвещение, 1992.
13. Потапов В.М., Татаринчик С.Н. Органическая химия. — М.: Химия, 1989.
14. Рэмсден Э.Н. Начала современной химии. — Л.: Химия, 1989.
