
- •Для студентів спеціальностей хіміко-технологічного профілю Частина і
- •Кірсенко Тетяна Володимирівна
- •Хімічна термодинаміка
- •Стислі теоретичні відомості
- •1.2. Завдання 1. Розрахунок термодинамічних характеристик
- •Задача 1
- •Задача 2
- •Хімічна рівновага
- •Стислі теоретичні відомості
- •2.2. Завдання 2. Розрахунок констант рівноваги хімічних реакцій
- •Фазові рівноваги
- •Стислі теоретичні відомості
- •3.2. Завдання 3. Визначення фізико-хімічних властивостей одно-
- •Додаток 3
- •Продовження додатку 6
- •Додаток 8
- •Список рекомендованої літератури
1.2. Завдання 1. Розрахунок термодинамічних характеристик
хімічних та фізичних процесів
Задача 1
Для наведеної в додатку 1 реакції:
визначити теплові ефекти та
 при T
= 298 К;
при T
= 298 К;розрахувати наближене значення
 за умови
;
за умови
;вивести рівняння залежності від Т, розрахувати за цим рівнянням при температурах 400, 500 та 600 К, побудувати графік залежності (за чотирма точками);
вивести рівняння залежності від Т , визначити інтервал темпера-тур, в якому це рівняння можна застосовувати;
розрахувати за виведеним рівнянням при температурах 400, 500, 600 К і побудувати графік залежності
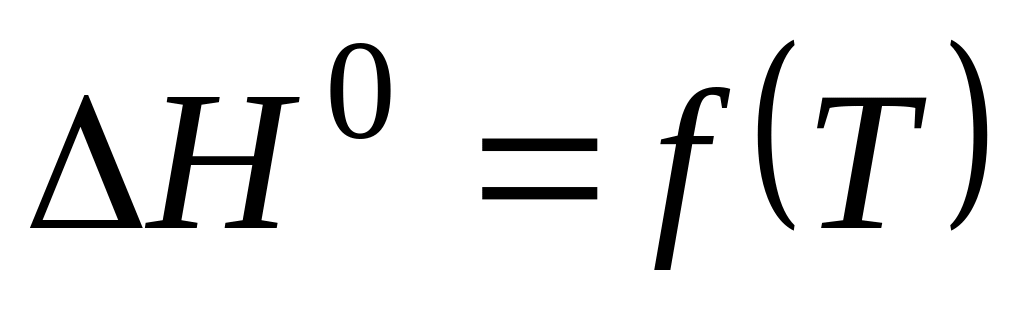 (за чотирма точками);
(за чотирма точками);визначити
 ,
,
 (двома методами) та
(двома методами) та
 (двома
методами);
(двома
методами);розрахувати
 :
:
а) наближено за умови ;
б)
точно, використовуючи рівняння
![]() .
.
визначити величини
 та
та
 за методом Тьомкіна-Шварцмана;
за методом Тьомкіна-Шварцмана;побудувати графік залежності
 за чотирма точками та визначити за ним
і
за чотирма точками та визначити за ним
і
 ;
;зробити висновки стосовно напрямку перебігу реакції в інтервалі температур 298 – 700 К.
Задача 2
За умови стандартного тиску 1 моль рідини нагрівають від 298 К до температури кипіння, а потім внаслідок ізотермічного розширення тиск пари, що утворилась, зменшується до “р” (дод. 2). Визначити сумарну зміну ентальпії та ентропії цього процесу, вважаючи, що .
Хімічна рівновага
Стислі теоретичні відомості
Стан рівноваги оборотного хімічного процесу
![]()
характеризується
константою рівноваги
 ,
що виражена через
,
що виражена через
рівноважні
молярні концентрації учасників реакції,
або константою рівноваги
 ,
що виражена через їх рівноважні парціальні
тиски.
,
що виражена через їх рівноважні парціальні
тиски.
Константи
рівноваги
![]() та
та
![]() пов’язані співвідношенням
пов’язані співвідношенням
![]() ,
де
– зміна кількості молів газоподібних
речовин внаслідок перебігу хімічної
реакції.
,
де
– зміна кількості молів газоподібних
речовин внаслідок перебігу хімічної
реакції.
Рівняння ізотерми хімічної реакції пов’язує зміну ізобарного потенціалу внаслідок реакції та її константу рівноваги:
 ,
,
де
![]() - нерівноважний (вихідний) парціальний
тиск і-
того учасника реакції.
- нерівноважний (вихідний) парціальний
тиск і-
того учасника реакції.
Якщо
відома константа рівноваги реакції та
вихідні тиски кожного газу, то за
рівнянням ізотерми можна визначити
напрямок перебігу хімічного процесу.
Самочинні ізотермічні процеси
уможливлюються за умови зменшення
ізобарного потенціалу, тому при
![]() реакція перебігатиме у напрямку утворення
продуктів, а при
реакція перебігатиме у напрямку утворення
продуктів, а при
![]() - у напрямку вихідних речовин. Якщо
- у напрямку вихідних речовин. Якщо
![]() ,
то система перебуває у стані рівноваги.
,
то система перебуває у стані рівноваги.
За умови =1 атм стандартна зміна ізобарного потенціалу за будь-якої температури складає:
![]() .
.
Таким чином, за стандартною зміною енергії Гіббса можна обчислити константу рівноваги за рівнянням:
![]() .
.
Визначена за цим рівнянням константа рівноваги має розмірність (атм)n . Для переведення в СІ (Па)n її потрібно помножити на (1,013105)n.
Температурну залежність константи рівноваги описує рівняння ізобари хімічної реакції:
![]() .
.
Інтегрування
цього рівняння з урахуванням одержаної
раніше залежності
![]() уможливлює точне обчислення константи
рівноваги при різних температурах за
рівнянням:
уможливлює точне обчислення константи
рівноваги при різних температурах за
рівнянням:
![]() ,
,
де - стала інтегрування в залежності .
Сталу інтегрування В розраховують за відомою константою рівноваги при 298 К за формулою:
![]()
Значення В потрібно обчислити з точністю до тисячних.
