- •Глава V физико-химия растворов биополимеров
- •Классификация и химическое строение вмс
- •Растворы вмс
- •Осмотическое давление растворов вмс
- •Вязкость растворов вмс
- •Устойчивость растворов вмс и способы выделения биополимеров из их растворов
- •Методы измерения иэт белков
- •Основные вопросы темы
- •Экспериментальные работы
- •Тестовый самоконтроль
- •Задачи и упражнения
- •Эталоны решения задач
Осмотическое давление растворов вмс
Осмотическое давление растворов низкомолекулярных и высокомолекулярных веществ определяется теоретически уравнением Вант-Гоффа:
Росм. = CRT, (29)
Осмотическое давление можно выразить и по другому:
Росм.![]() ,
(29а)
,
(29а)
где С – концентрация растворенного вещества в г/л, а М – молярная масса растворенного вещества.
Таким образом, уравнение (29а) можно использовать для определения молярных масс. Рассмотрим систему, в которой раствор, содержащий 20 г гемоглобина в 1 л, помещен в правый сосуд, а чистая вода - в левый, отделенный от правого полупроницаемой мембраной (рис.44). После достижения равновесия высота столба воды в правом сосуде на 7,78 см превышает высоту в левом сосуде.
Температура системы поддерживается постоянной, равной 2980 К. Какой же будет молярная масса гемоглобина ?
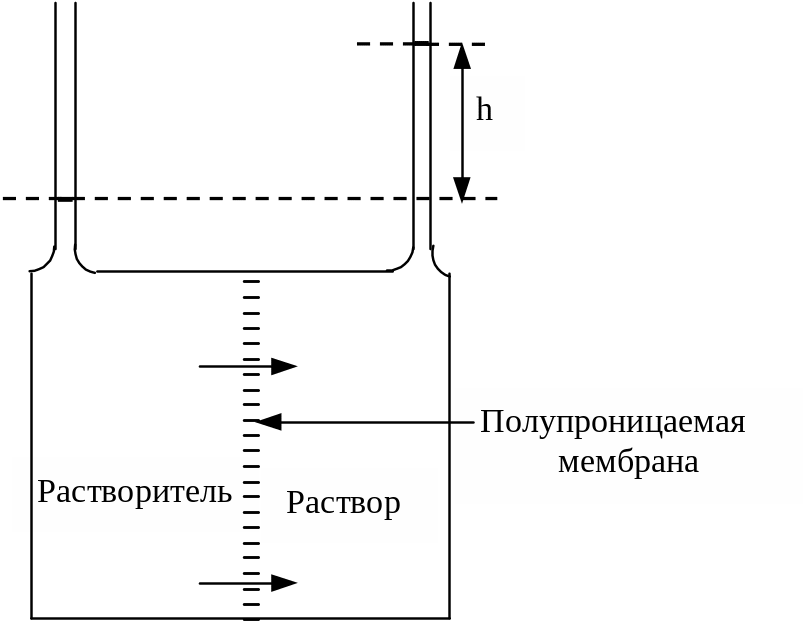
Рис. 44. Схема прибора для демонстрации осмотического давления
Для
ее определения сначала рассчитаем
осмотическое давление раствора. Поскольку
![]() ,
где А –
площадь сечения трубки (м2);
h
– разность высот менисков (0,0778 м);
– плотность раствора (103
кг/м3);
g
– ускорение свободного падения (9,807
м/с2).
,
где А –
площадь сечения трубки (м2);
h
– разность высот менисков (0,0778 м);
– плотность раствора (103
кг/м3);
g
– ускорение свободного падения (9,807
м/с2).
Таким образом:
Росм.= 0,0778 м103 кг/м39,807 м/с2 = 762,46 кг/мс2 = 762,46 н/м2
Согласно уравнению (29а).
![]()
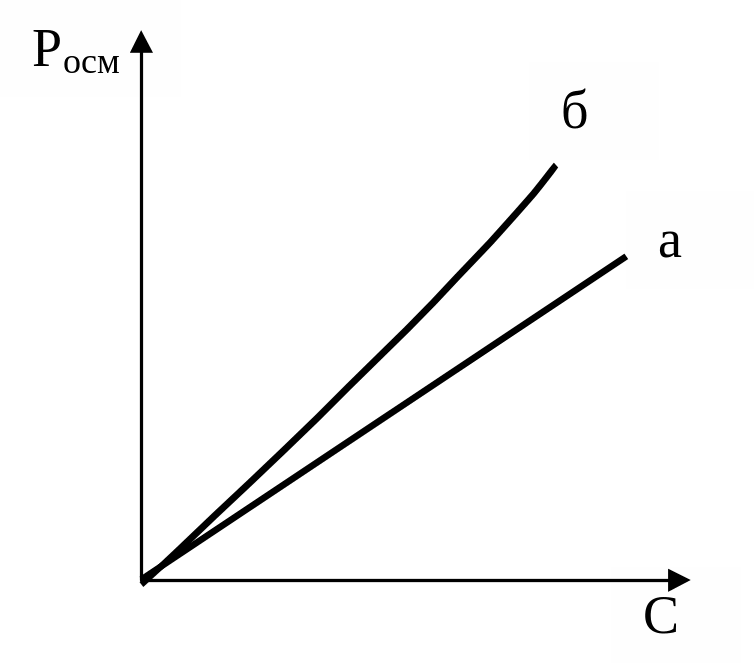
С повышением концентрации ВМС (кроме глобулярных полимеров) их осмотическое давление перестает подчиняться закону Вант-Гоффа и растет быстрее (рис.45). Причиной отклонений от закона Вант-Гоффа является относительная независимость теплового движения отдельных сегментов линейных макромолекул ВМС. Каждая макромолекула ведет себя как совокупность нескольких молекул меньшего размера. Это и проявляется в увеличении осмотического давления. Для расчета осмотического давления растворов ВМС Галлер предложил уравнение:
Росм.![]() ,
(30)
,
(30)
где, С – концентрация раствора ВМС, г/л; М – молярная масса ВМС, г/моль; – коэффициент, учитывающий гибкость и форму макромолекулы в растворе.
Коэффициент
зависит от природы растворителя и
растворенного вещества, но не зависит
от молярной массы растворенного полимера.
С увеличением длины макромолекулы и
разветвленности цепи величина
растет. Увеличение эффективного числа
подвижных единиц (кинетически активных
единиц) в растворе учитывается
дополнительным слагаемым С2.
При небольших концентрациях полимера
значение слагаемого невелико и уравнение
Галлера переходит в уравнение Вант-Гоффа.
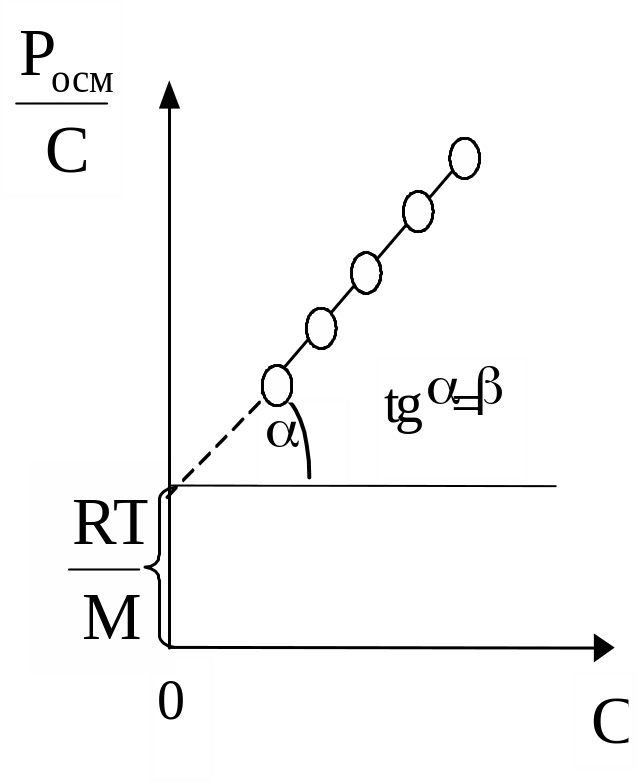
Уравнение Галлера можно преобразовать
в уравнение прямой, разделив обе части
его на С:
![]() (31)
(31)
Рис.45. Зависимость осмотического давления от концентрации раствора ВМС: а – теоретическая кривая в соответствии с уравнением Вант-Гоффа; б – экспериментальная кривая |
Рис.46. График зависимости Росм /С от концентрации С
|
Измерив осмотическое давление растворов с различной концентрацией С, можно построить графическую зависимость величины Росм./С от С и найти значение молярной массы М полимера и коэффициента (рис.46).
Осмометрическим методом обычно пользуются для определения молярных масс ВМС в интервале от 10000 до 70000 г/моль. Нижний предел зависит от свойств мембран, а верхний определяется той чувствительностью, при которой можно измерять осмотическое давление. Погрешность результатов измерений осмотического давления растворов ВМС может быть связано с присутствием в растворе низкомолекулярных электролитов. Чтобы предотвратить влияние последних, раствор ВМС предварительно диализуют.
Следует заметить, что молярные массы ВМС нельзя определить традиционным криоскопическим методом. Это объясняется тем, что разбавленные растворы ВМС в общем случае не подчиняются закону Рауля. Поэтому, кроме описанного выше осмометрического метода разработаны и другие методы определения молярных масс ВМС: химический, вискозиметрический, методы седиментации и светорассеяния растворов, метод гель-фильтрации, электрофоретические и т.д. Ни один из перечисленных методов не является универсальным, так как каждый из них можно применять только при определенном диапазоне молярных масс полимеров.