
- •Глава I Элементы химической термодинамики Биомедицинская значимость темы
- •Задачи химической термодинамики
- •Основные понятия и определения Термодинамическая система
- •Состояние системы, стандартное состояние
- •Уравнение состояния
- •Функции состояния
- •Процессы
- •Энергия. Внутренняя энергия
- •Работа и теплота
- •Первый закон термодинамики
- •Формулировка и математическое выражение первого закона
- •Термохимия
- •Закон Гесса
- •Следствия из закона Гесса
- •Тепловые эффекты различных процессов
- •Биохимических процессов
- •Решение
- •Второй закон термодинамики
- •Обратимые и необратимые процессы
- •Самопроизвольные и несамопроизвольные процессы
- •Изменение энтропии изолированной системы
- •Статистическая природа второго закона термодинамики
- •Абсолютные и стандартные энтропии
- •Расчет изменения энтропии для протекании химического процесса
- •Энергия Гиббса
- •Расчет g0 в химических реакциях
- •Решение
- •Решение
- •Термодинамика химического равновесия
- •Уравнение изотермы химической реакции.
- •Уравнение изобары химической реакции
- •Основные вопросы темы
- •Экспериментальные работы
- •Тестовый самоконтроль
- •Глава II Химическая кинетика и катализ Биомедицинская значимость темы
- •Основные понятия химической кинетики
- •Исходные, конечные и промежуточные вещества
Тепловые эффекты различных процессов
1. Теплота растворения – это количество энергии, которое выделяется или поглощается при растворении 1 моля вещества в количестве растворителя, достаточном для полной сольватации (на 1 моль вещества 300 – 400 молей растворителя).
Теплота растворения равна сумме двух слагаемых:
Нрастворения = Н1 + Н2
где Н1 – теплота перехода твердого или газообразного вещества в то состояние, в котором оно существует в растворе.
Н2 – теплота взаимодействия растворяемого вещества с растворителем (теплота сольватации или теплота гидратации, если растворителем является вода).
Н2 всегда отрицательна, а Н1 может быть и положительна и отрицательна.
П
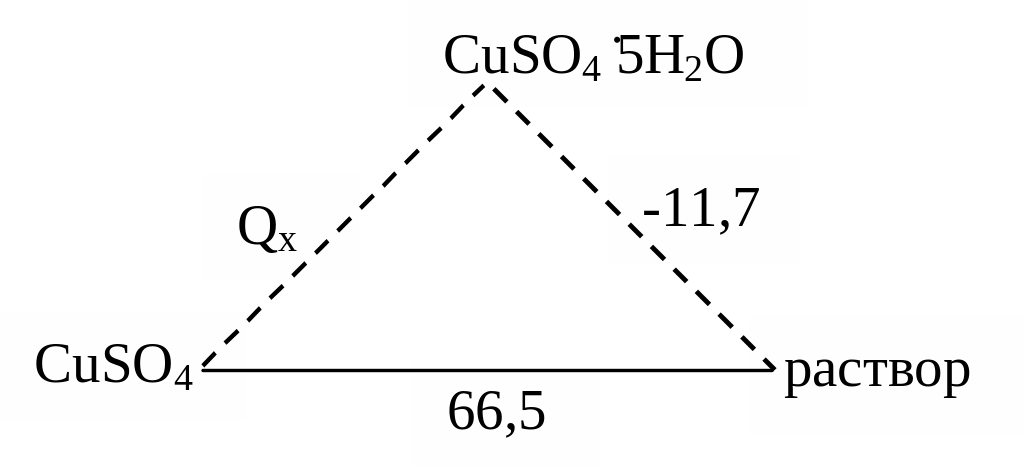
66,5 = Qx –11,7.
Отсюда: Qх = + 78,2 кДж; Н = –78,2кДж
2. Теплота нейтрализации – это количество энергии, которое выделяется при образовании одного моля воды из Н+ (Н3О+) и ОН– при стандартных условиях:
NaOH + HCl = NaCl + H2O или
H+(aq) + OH–(aq) = H2O(ж) + 56,98 кДж
При взаимодействии сильной кислоты и сильного основания, независимо от их природы, теплота нейтрализации будет постоянной и равна 56,98 кДж.
Если в реакцию вступает слабая кислота или слабое основание, то теплота нейтрализации будет меньше, так как ионизация кислоты (основания) потребует затраты энергии.
HCN + NaOH = NaCN + H2O + Q
HCN + OH– = CN– + H2O + Q; Q < 56,98 кДж
3. Теплота фазовых превращений – это количество энергии, которое выделяется или поглощается в процессе перехода компонентов системы из одной фазы в другую.
Пример. Вычислить тепловой эффект перехода Si (аморфный) Si (кристаллический), если теплоты сгорания этих модификаций составляют 867,3 и 850,6 кДж соответственно. Аморфный кремний можно сразу окислить до SiO2:
Si(ам) + О2 =SiO2 + 867,3 кДж, а можно сначала превратить его в кристаллическую модификацию, которую затем подвергнуть окислению.
1. Si (ам) = Si (крист.) + Qx
2. Si (крист.) + О2 = SiO2 + 850,6 кДж
867,3 – 850,6 = 16,7 кДж
Н = – 16,7 кДж
Термохимические расчеты и их использование для характеристики
Биохимических процессов
Значения стандартных энтальпий образования и сгорания различных веществ имеются в справочниках. Эти значения используются для расчета тепловых эффектов различных процессов, в том числе и биохимических реакций.
Типовая задача. Рассчитать тепловой эффект реакции окисления глюкозы:
С6Н12О6(г) + 6О2(г) = 6Н2О(ж) + 6СО2(г); Н0 = ?
Н0обр.[C6H12O6(т)] = –1260 кДж/моль;
Н0обр.[CO2(г)] = –393,5 кДж/моль;
Н0обр.[H2O(ж)] = –285,8 кДж/моль.
Решение
Н0реакции = (6Н0обр[H2O(ж)] + 6H0обр[CO2(г)]) – H0обр[C6H12O6(т)] =
((6(–285,8) + 6(–393,5)) – (–1260) = –2815,8 кДж.
Исходя из закона Гесса, следует, что при окислении 1 моль глюкозы в живых организмах выделится такое же количество энергии.
Второй закон термодинамики
Первый закон термодинамики позволяет составить энергетический баланс протекающего в системе процесса, но не указывает, в каком направлении и до какого предела будет протекать этот процесс. Согласно первому закону термодинамики, возможен, например, самопроизвольный переход энергии как от горячего тела к холодному, так и от холодного к горячему. Однако, опыт показывает, что энергия самопроизвольно переходит от тела более нагретого к телу менее нагретому. Обратный процесс не протекает. Сколько бы мы не ждали, вода в чайнике, стоящем на столе, не закипит за счет энергии окружающей среды.
С точки зрения первого закона термодинамики все процессы, происходящие без нарушения закона сохранения энергии, возможны. Однако, опыт показывает, что самопроизвольные процессы в природе протекают только в определенном направлении и до определенного предела. Первый закон термодинамики необходимо дополнить законом, который позволял бы судить о направлении самопроизвольных процессов и пределах их протекания. Таким законом является эмпирический закон, установленный на основании большого человеческого опыта. Справедливость этого закона подтверждается тем, что ни одно из его следствий не находится в противоречии с опытом.
Второй закон термодинамики тесно связан с существованием необратимых процессов. Прежде, чем рассмотреть содержание и формулировку второго закона термодинамики, познакомимся с понятием «необратимые» и «обратимые» процессы в термодинамическом смысле.
