
- •Глава I Элементы химической термодинамики Биомедицинская значимость темы
- •Задачи химической термодинамики
- •Основные понятия и определения Термодинамическая система
- •Состояние системы, стандартное состояние
- •Уравнение состояния
- •Функции состояния
- •Процессы
- •Энергия. Внутренняя энергия
- •Работа и теплота
- •Первый закон термодинамики
- •Формулировка и математическое выражение первого закона
- •Термохимия
- •Закон Гесса
- •Следствия из закона Гесса
- •Тепловые эффекты различных процессов
- •Биохимических процессов
- •Решение
- •Второй закон термодинамики
- •Обратимые и необратимые процессы
- •Самопроизвольные и несамопроизвольные процессы
- •Изменение энтропии изолированной системы
- •Статистическая природа второго закона термодинамики
- •Абсолютные и стандартные энтропии
- •Расчет изменения энтропии для протекании химического процесса
- •Энергия Гиббса
- •Расчет g0 в химических реакциях
- •Решение
- •Решение
- •Термодинамика химического равновесия
- •Уравнение изотермы химической реакции.
- •Уравнение изобары химической реакции
- •Основные вопросы темы
- •Экспериментальные работы
- •Тестовый самоконтроль
- •Глава II Химическая кинетика и катализ Биомедицинская значимость темы
- •Основные понятия химической кинетики
- •Исходные, конечные и промежуточные вещества
Основные вопросы темы
Предмет и задачи химической термодинамики. Химическая термодинамика как основа биоэнергетики. Системы: изолированные, закрытые, открытые.
Первый закон термодинамики. Внутренняя энергия, теплота, работа. Изобарный и изохорный тепловые эффекты. Энтальпия.
Закон Гесса. Следствия из закона Гесса. Стандартные теплоты образования и сгорания. Термохимические расчеты и их использование для энергетической характеристики биохимических процессов.
Взаимосвязь между процессами обмена веществ и энергии. Калорийность основных составных частей пищи и некоторых пищевых продуктов. Расход энергии при различных режимах двигательной активности.
Термодинамически обратимые и необратимые процессы. Второй закон термодинамики. Энтропия. Статистическое и термодинамическое толкование энтропии. Стандартная энтропия.
Свободная энергия Гиббса (изобарно–изотермический потенциал). Энтальпийный и энтропийный фактор. Экзо– и эндоэргонические процессы в организме.
Термодинамика химического равновесия. Обратимые и необратимые реакции. Понятие о химическом равновесии. Константа химического равновесия. Взаимосвязь между константой химического равновесия и свободной энергией Гиббса. Уравнения изотермы и изобары химической реакции.
Экспериментальные работы
Работа № 1 . Определение теплового эффекта реакции нейтрализации.
Приборы и реактивы:
Калориметр
1н раствор NaOH
1н раствор HCl
Выполнение работы. Во взвешенный калориметрический стакан налить 125 мл 1н раствора NaOH (р=1,037). В другой стакан налить 125 мл 1н раствора HCl (р = 1,014). Измерить температуру обоих растворов. Затем при работающей мешалке через воронку влить раствор кислоты в калориметр и следить за изменением температуры. Отметить максимальную температуру раствора. Результаты опыта записать в таблицу.
М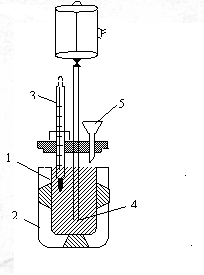 асса
калориметрического стакана – m1
асса
калориметрического стакана – m1
Концентрация раствора NaOH
Концентрация раствора HCl
Объем раствора NaOH, V, мл
Объем раствора HCl, V , мл
Температура раствора NaOH – tщ
Температура раствора HCl – tк
Начальная температура t1 = 0,5(tщ + tк)
Температура после нейтрализации – t2
Рис. 7. Схема калориметра.
1. Сосуд с раствором (реакционная камера)
2. Внешний сосуд, 3.Термометр
4. Мешалка 5.Воронка
Общая масса растворов m2 = (pщVщ + p кV к)
Рассчитать теплоту нейтрализации, используя формулу: Q = tC/NV, где
t = t2 – t1, С – общая теплоемкость калориметра
C = m1C1 + m2C2
C1= 0,752 дж/г. град – удельная теплоемкость стекла
C2= 4,184 дж/г. град – удельная теплоемкость раствора,
N – конечная концентрация раствора (0,5 н),
V – общий объем раствора (0,25 л).
Составить термохимическое уравнение реакции нейтрализации:
NaOH + HCl = NaCl + H2O; H = ?
Вычислить абсолютную и относительную ошибки опыта, если
Hтеор. = –57,0 кДж/моль Н2О
Абсолютная ошибка = Hтеор. –H
Относительная ошибка, % = (Hтеор. – H)/ Hтеор.) 100%
Тестовый самоконтроль
Закрытая система – эта система, которая:
а) обменивается с окружающей средой только веществом
б) обменивается с окружающей средой только энергией
в) обменивается с окружающей средой веществом и энергией
г) не обменивается с окружающей средой ни энергией, ни веществом
Гомогенная система – это
а) раствор сахара в воде
б) осадок сульфата бария в контакте с водой
в) смесь азота и кислорода при 00С
г) смесь воды и льда при 00С
Экспериментально можно определить значение следующих термодинамических параметров состояния системы:
а) масса б) внутренняя энергия
в) энтальпия г) абсолютная энтропия
В системе протекает термодинамический процесс, если:
а) объем системы уменьшается
б) температура в системе повышается на 10С
в) изменяется химический состав вещества системы
г) система перемещается в окружающей среде
Функциями состояния системы являются:
а) энтальпия б) теплота
в) работа г) свободная энергия Гиббса
Укажите математическое выражение первого закона термодинамики для изохорных процессов:
а) Q = A б) Q = H в) Q = U г) A = – U
Укажите вид процесса, при котором энергия, сообщенная системе в форме теплоты, равна изменению энтальпии системы:
а) изотермический б) изохорный
в) изобарный г) адиабатный
Какие из следующих утверждений верны:
а) абсолютное значение энтальпии системы можно экспериментально определить
с помощью калориметра
б) Н является положительной величиной для эндотермической реакции
в) энтальпия образования сложного вещества равна величине, но противоположна
по знаку энтальпии разложения этого вещества
г) тепловой эффект химической реакции равен сумме энтальпий сгорания продук–
тов реакции за вычетом суммы энтальпий сгорания исходных продуктов с уче–
том стехиометрических коэффициентов в уравнении реакции.
Укажите неравенство, которое однозначно характеризует эндотермическую реакцию:
а) H> 0 б) S > 0 в) H < 0 г) G > 0
Тепловой эффект Н химической реакции, протекающей в изохорных или изобарных условиях, зависит от:
а) природы реагирующих веществ
б) количества реагирующих веществ
в) агрегатного состояния исходных веществ и продуктов реакции
г) способа превращения исходных веществ в продукты реакции.
Укажите формулу, которая соответствует математическому выражению второго закона термодинамики для обратимых процессов:
а) Q = U + p V б) H = H1 + H2 + H3
в) S = Q/T г) S > Q/T
Если в изолированной системе протекают самопроизвольные процессы, то энтропия системы:
а) уменьшается
б) сначала увеличивается, а затем уменьшается
в) увеличивается
г) не изменяется
Не производя вычислений, укажите процессы, при протекании которых энтропия системы возрастает:
а) Н2О(ж) Н2О(г)
б) Н2 (г) + 0,5О2(г) Н2О(г)
в) С(т) + СО2(г) 2СО(г)
г) 2KClO3(т) 2KCl(т) + 3О2(г)
Укажите химические реакции, для которых превращением исходных веществ в продукты сопровождается одновременным уменьшением энтальпии и возрастанием энтропии:
а) KClO3(т) KCl(т) + 1,5O2(г) H< 0
б) H2(г) + 0,5O2(г) H2O(г) H < 0
в) H2O(ж) H+(водн.) + OH– (водн.) H > 0
г) 0,5C(т) + 0,5О2(г) CO(г) H < 0
Критерием принципиальной невозможности самопроизвольного протекания изобарно–изотермического процесса является неравенство:
а) H > 0 б) S < 0 в) G < 0 г) G > 0
В каком из следующих случаев химическая реакция может протекать самопроизвольно при любой температуре:
а) H> 0; S > 0 б) H < 0 ; S > 0
в) H > 0; S < 0 г) H < 0; S < 0
Укажите неравенство, которое однозначно характеризует эндоэргоническую реакцию:
а) H < 0 б) H > 0 в) G < 0 г) G > 0
Какое из следующих утверждений однозначно характеризует экзоэргоническую реакцию:
а) энтальпия системы в ходе реакции уменьшается
б) энтальпия системы возрастает
в) свободная энергия Гиббса продуктов реакции меньше, чем исходных веществ
г) свободная энергия Гибса продуктов реакции больше, чем исходных веществ
Химическое равновесие в реакционной системе достигается при условии, когда:
а) G = 0
б) G < 0
в) скорости и прямой и обратной реакции одинаковы
г) G > 0
Самопроизвольно протекающая химическая реакция сопровождается понижением энтальпии системы. Как изменяется константа химического равновесия этой реакции при увеличении температуры:
а) возрастает б) уменьшается в) не изменяется
ЗАДАЧИ
Вычислить G0 реакции и определить возможность ее осуществления в стандартных условиях:
2NH3(г) + 2,5О2(г) = 2NO(г) + 3Н2О(ж)
Ответ: –505,56 кДж/моль
Вычислить изменение энтропии (S0) в реакции:
2NH3(г) + Н2SO4(ж) = (NH4)2SO4(т)
Ответ: –321,6 Дж/мольК
Вычислить H0 реакции: Н2О(г) + СО(г) = СО2(г) + Н2(г)
Ответ: – 41,2 кДж
Исходя из уравнения реакции: H2S(г) + 1,5O2(г) = H2O(ж) + SО2(г) вычислить энтальпию образования Н2S, если H0р–ции = –563 кДж
Ответ: – 19,7 кДж/моль
Используя данные H0р–ции = –101,2 кДж и S0р–ции = –182,82 Дж/мольК, для реакции: 2HCl(г) + 1/2О2(г) = Cl2(г) + Н2О(ж),
вычислить G0 реакции и определить возможность ее осуществления в стандартных условиях
Ответ: –46,9 кДж/моль
