
Сложные реакции Реакции с последовательными стадиями

протекают с образованием одного или нескольких промежуточных продуктов реакции Х. Если начальная и конечная молекула не тождественны друг другу (А С), то концентрация реагентов изменяется. Если в результате реакции образуется один из исходных реагентов (А С), то реакция называется цепной.
В параллельных реакциях

Исходное вещество имеет способность реагировать с окружающей средой по нескольким независимым каналам.
Сопряженные реакции характеризуются тем, что реакция А + В2 может протекать только в присутствии индуктора В1. Реакцию можно представить в виде двух элементарных процессов
А + В1 = Х + …,
Х + В2 = С + …,
в которых решающую роль играет промежуточный продукт Х.
Каталитические реакции – это сопряженные реакции, в которых вещество – индуктор, называемое здесь катализатором, претерпевая замкнутый цикл превращений, восстанавливается в конце реакции.
Мономолекулярные реакции
Мономолекулярные реакции типа (5.1) протекают с заметной скоростью лишь в том случае, когда реагирующая молекула обладает внутренней энергией, большей, чем а. Следовательно, процесс протекает в две стадии. Сначала молекула за счет термических процессов или возбуждения внешним источником (светом, электронным ударом) приобретает избыточную энергию
 .
(5.13) Затем
энергия сосредотачивается на определенных
степенях свободы, образуя активированную
молекулу с последующим ее распадом:
.
(5.13) Затем
энергия сосредотачивается на определенных
степенях свободы, образуя активированную
молекулу с последующим ее распадом:
 .
(5.14)
.
(5.14)
Для анализа макроскопической константы k термической диссоциации используем гипотезу сильных столкновений. Практически любой физико-химический процесс можно рассматривать как релаксационный. Даже процесс возбуждения какого-либо состояния внешним источником, в сущности, является процессом релаксации расширенной системы, включающей источник возбуждения.
Очевидно, что эффективная скорость реакции в значительной мере определяется скоростью энергетической релаксации продуктов. Если последняя велика, то мала скорость обратного процесса. В этом случае происходит стабилизация продукта реакции. Поскольку для многоатомных систем рассчитать k(, ) практически невозможно, то для оценки обычно используют две альтернативные гипотезы.
В гипотезе ступенчатой активации и дезактивации предполагается, что при одном столкновении пробной молекулы А с молекулой теплового резервуара М энергия А меняется в среднем на величину, меньшую Т. При этом релаксация идет по диффузионному механизму и описывается уравнением Фоккера – Планка.
В гипотезе сильных столкновений предполагается, что каждое столкновение активной молекулы А + М приводит к ее дезактивации, а активация, наоборот, происходит из равновесного состояния. В этом случае релаксационное уравнение неравновесной функции распределения Х() будет
 ,
(5.15) где
,
(5.15) где
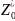 – эффективное число дезактивирующих
столкновений М
с АВ*
при единичной концентрации М,
имеющее размерность см3/с.
Добавив в правую часть (5.15) член –
k*()X()
и решая задачу в квазистационарном
приближении, получаем
– эффективное число дезактивирующих
столкновений М
с АВ*
при единичной концентрации М,
имеющее размерность см3/с.
Добавив в правую часть (5.15) член –
k*()X()
и решая задачу в квазистационарном
приближении, получаем
 .
(5.16) Отсюда
.
(5.16) Отсюда
 .
(5.17)
.
(5.17)
В
пределе больших давлений Х()
Х0()
реакция
является реакцией первого порядка. При
малых давлениях
 и
и
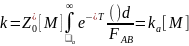 (5.19)
В этом случае скорость реакции определяется
величиной константы скорости активации
ka
и линейно растет с давлением и реакция
становится реакцией второго порядка.
(5.19)
В этом случае скорость реакции определяется
величиной константы скорости активации
ka
и линейно растет с давлением и реакция
становится реакцией второго порядка.
