
Лекция 5.
Кинетика и механизм газофазных реакций.
Простые реакции, константы равновесия.
Наиболее важной характеристикой любой реакции является так называемая константа скорости реакции (или удельная скорость реакции), т.е. скорость образования продукта реакции при концентрации каждого из реагирующих веществ равной единице. Все реакции можно разделить на простые и сложные. Реакции, протекающие в одну стадию, при одновременном взаимодействии n частиц называются простыми реакциями. Если n = 1, имеем реакцию первого порядка; при n = 2 или 3 – реакции второго и третьего порядков соответственно.
Примером реакции первого порядка может служить термическая диссоциация молекулы
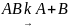 .
(5.1) Скорость
реакции определяется из выражения
.
(5.1) Скорость
реакции определяется из выражения
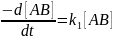 .
(5.2) Здесь и
далее квадратные скобки обозначают
концентрацию данного вещества (в данном
случае молекулы АВ). Концентрация
исходного вещества при реакции первого
порядка уменьшается экспоненциально.
Константу скорости k1
можно определить экспериментально,
измерив концентрацию в момент времени
t:
.
(5.2) Здесь и
далее квадратные скобки обозначают
концентрацию данного вещества (в данном
случае молекулы АВ). Концентрация
исходного вещества при реакции первого
порядка уменьшается экспоненциально.
Константу скорости k1
можно определить экспериментально,
измерив концентрацию в момент времени
t:
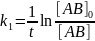 ,
(5.3)
,
(5.3)
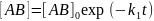 .
.
Размерность k1 равна с-1.
Константы скорости реакций второго и третьего порядка, как видно из выражений
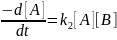 ,
(5.4)
,
(5.4)
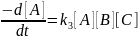 ,
(5.5) имеют размерность
см3/с
и см6/с
соответственно. Здесь А, В, С – исходные
реагенты. Константа скорости k
является макроскопической величиной.
Ее значение зависит от термодинамического
состояния системы. Рассмотрим связь
макроскопической константы скорости
реакции со скоростями элементарных
процессов на примере столкновения двух
молекул А
и В:
,
(5.5) имеют размерность
см3/с
и см6/с
соответственно. Здесь А, В, С – исходные
реагенты. Константа скорости k
является макроскопической величиной.
Ее значение зависит от термодинамического
состояния системы. Рассмотрим связь
макроскопической константы скорости
реакции со скоростями элементарных
процессов на примере столкновения двух
молекул А
и В:
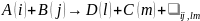 ,
(5.6) где i,
j,
l,
m
– наборы квантовых чисел, фиксирующих
начальные и конечные состояния молекул.
Если при столкновении не происходит
обмена атомами, т.е. (
,
(5.6) где i,
j,
l,
m
– наборы квантовых чисел, фиксирующих
начальные и конечные состояния молекул.
Если при столкновении не происходит
обмена атомами, т.е. (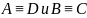 ),
то мы наблюдаем просто рассеяние частиц.
Если при этом и
= 0,
то рассеяние называется упругим. Реакция
называется квазирезонансной, если
~ 0.
),
то мы наблюдаем просто рассеяние частиц.
Если при этом и
= 0,
то рассеяние называется упругим. Реакция
называется квазирезонансной, если
~ 0.
Скорость реакции может быть записана через функции распределения исходных частиц по скоростям f()
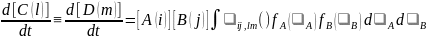 ,
(5.7) где
- скорость относительного движения.
Величину
,
(5.7) где
- скорость относительного движения.
Величину
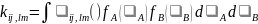 (5.8)
называют микроскопической константой
скорости элементарного процесса. Если
начальные состояния i
и
j
не фиксированы, а описываются некоторыми
функциями распределения
(5.8)
называют микроскопической константой
скорости элементарного процесса. Если
начальные состояния i
и
j
не фиксированы, а описываются некоторыми
функциями распределения
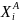 и
и
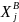 ,
то полная скорость реакции из любого
начального состояния во все конечные
равна
,
то полная скорость реакции из любого
начального состояния во все конечные
равна
 .
(5.9) Отсюда видно, что макроскопическая
константа скорости реакции
.
(5.9) Отсюда видно, что макроскопическая
константа скорости реакции
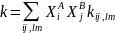 (5.10)
зависит как соответствующих сечений,
так и от функций распределения f()
и
Х,
которые в общем случае могут быть
неравновесными. Заметим, что частным
случаем, является уравнение Саха для
ионизационного равновесия
(5.10)
зависит как соответствующих сечений,
так и от функций распределения f()
и
Х,
которые в общем случае могут быть
неравновесными. Заметим, что частным
случаем, является уравнение Саха для
ионизационного равновесия
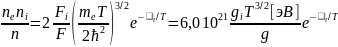 .
(5.11)
.
(5.11)
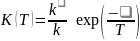 ,
(5.12) Величину
К(Т)
называют константой равновесия, где k
и
k
относятся к прямой и обратной реакции.
,
(5.12) Величину
К(Т)
называют константой равновесия, где k
и
k
относятся к прямой и обратной реакции.
Экспоненциальная зависимость k от Т была обнаружена экспериментально еще в XIX веке. Аррениус (1889) дал физическое объяснение этому факту, предположив, что в реакцию вступают только молекулы, обладающие энергией выше некоторой энергии 0, а константа скорости имеет вид k = A(T)exp(-0/T), где предэкспоненциальный множитель А также зависит от температуры. К вопросу о пороге реакции мы еще вернемся, а сейчас упомянем о чрезвычайно важном принципе детального равновесия, применение которого часто позволяет оценить скорость интересующего нас процесса. В соответствии с этим принципом при термодинамическом равновесии скорости прямых и обратных процессов равны не только интегрально, но и «детально» - для каждого из возможных каналов реакции и для каждого микроскопического состояния реагентов и продуктов.
