
- •Вопрос 1
- •Вопрос 2
- •Вопрос 3
- •Вопрос 4
- •Вопрос 5
- •Вопрос 6
- •Вопрос 7
- •Вопрос 8
- •Вопрос 9
- •Вопрос 10
- •Вопрос 11
- •Вопрос 13.
- •Вопрос 14
- •Вопрос 15
- •Вопрос 16
- •Вопрос 17
- •Вопрос 18
- •Вопрос 19
- •Вопрос 20
- •Вопрос 21
- •Вопрос 22
- •Вопрос 23
- •Вопрос 24
- •Вопрос 25
- •Вопрос 26
- •Вопрос 27
- •Вопрос 28
- •Вопрос 29
- •Вопрос 30 Защитные покрытия обеспечивают изоляцию металла от внешней среды и таким образом препятствуют протеканию коррозии. Покрытия делятся на металлические и неметаллические.
Вопрос 26
Совокупность окислительно-восстановительных процессов, происходящих на погруженных в электролит электродах под действием электрического тока, носит название электролиз.
Электролиз проводят в специальных аппаратах, называемых электролизерами, состоящими из двух электродов и электролита. Электрод, подключенный к отрицательному полюсу внешнего источника тока, называется катодом. На катоде происходит реакция восстановления. Электрод, подключенный к положительному полюсу внешнего источника тока, называется анодом. На аноде происходит реакция окисления. Продукты электрохимического окисления и восстановления могут вступать во вторичные реакции между собой, с электролитом и материалом электродов.
Последовательность электродных процессов. Если в электролите присутствуют несколько видов частиц, то возможно протекание нескольких электродных реакций. На катоде в первую очередь протекает процесс восстановления наиболее сильного окислителя, т.е. окислителя с наиболее положительным потенциалом. Последовательность восстановления окислителей можно оценить на основе значений стандартных восстановительных потенциалов соединений.
На аноде в первую очередь протекает процесс окисления наиболее сильного восстановителя, т.е. восстановителя с наиболее отрицательным потенциалом. Если материал анода имеет потенциал более отрицательный, чем потенциал окисления гидроксид-ионов до свободного кислорода, то происходит растворение анода и эта разновидность электролиза называется электролизом с растворимым анодом. В качестве нерастворимых анодов используют материалы с большими положительными восстановительными потенциалами (Pt, Au, C) или металлы с высокими значениями анодной поляризации (Ta, Ti, Fe в щелочной среде и др.).
Электролитическое получение алюминия. Исходным соединением является Al2O3. Оксид алюминия плавится при 2050оС. Поэтому электролизу подвергают раствор Al2O3 в расплавленном криолите при 950оС. В качестве материала анода используют графитовые стержни, а катодом служит железо, из которого изготавливается электролизная ванна. На электродах протекают следующие реакции:
катод: Al3+ +3e- → Al
анод: C + 2O2- -4e- → CO2
Материал анода в процессе электролиза расходуется.
Электролиз водного раствора хлорида натрия. В растворе присутствуют ионы Na+, H3O+, Cl- и ОН-. На катоде возможно протекание одного из трех процессов:
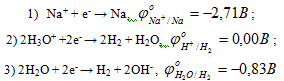
Наибольшее значение восстановительного потенциала отвечает второй реакции, однако, из-за малой концентрации ионов гидроксония в растворе реально протекает третья реакция и на катоде выделяется водород.
На аноде возможны процессы:
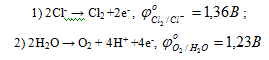
Потенциал второй реакции меньше, но перенапряжение этого процесса значительно больше, чем первой реакции и, по этой причине на аноде выделяется хлор. В результате электролиза в растворе накапливаются ионы натрия и гидроксид-ионы, поэтому продуктами процесса будут водород, хлор и гидроксид натрия.
Электролиз растворов солей с растворимым анодом сводится к окислению материала анода (его растворению) и сопровождается переносом металла с анода на катод. Это свойство широко используется при рафинировании (очистке) металлов от загрязнений.
