
- •Вопрос 1
- •Вопрос 2
- •Вопрос 3
- •Вопрос 4
- •Вопрос 5
- •Вопрос 6
- •Вопрос 7
- •Вопрос 8
- •Вопрос 9
- •Вопрос 10
- •Вопрос 11
- •Вопрос 13.
- •Вопрос 14
- •Вопрос 15
- •Вопрос 16
- •Вопрос 17
- •Вопрос 18
- •Вопрос 19
- •Вопрос 20
- •Вопрос 21
- •Вопрос 22
- •Вопрос 23
- •Вопрос 24
- •Вопрос 25
- •Вопрос 26
- •Вопрос 27
- •Вопрос 28
- •Вопрос 29
- •Вопрос 30 Защитные покрытия обеспечивают изоляцию металла от внешней среды и таким образом препятствуют протеканию коррозии. Покрытия делятся на металлические и неметаллические.
Вопрос 4
Закон Гесса: Тепловой эффект реакции не зависит от пути процесса при сохранении постоянных начальных и конечных условий опыта.
Следствие 1: Тепловой эффект реакции равен разности сумм теплот образования продуктов реакции и суммы теплот образования исходных продуктов , умноженной на стехиометрический коэффициент
Следствие 2: Тепловой эффект реакции равен разности суммы теплот сгорания исходных веществ и суммы теплот сгорания продуктов реакции, умнож. на стех.коэффициент.
Вопрос 5
Энтропия – это термодинамическая функция состояния системы. Она равна отношению малого количества тепла, которым система обменивается с окружающей средой к температуре Т:
dS= ᵹq/Т.
Температурная зависимость энтропии вещества представлена качественно на рис.2.1.
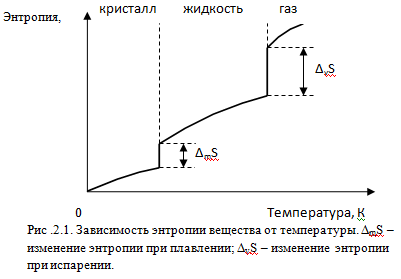
На рис.2.1 видно, что при нуле Кельвина энтропия вещества равна нулю. При повышении температуры энтропия плавно увеличивается, а в точках фазовых переходов имеет место скачкообразное увеличение энтропии, определяемое соотношением
![]() (2.14)
(2.14)
где Δ ф..п.S, Δф.п.Н и Тф.п. изменение энтропии, энтальпии и температура фазового перехода, соответственно.
Энтропию
вещества B в стандартном состоянии
обозначают ![]() .
Для многих веществ абсолютные значения
стандартных энтропий определены и
приводятся в справочных изданиях.
.
Для многих веществ абсолютные значения
стандартных энтропий определены и
приводятся в справочных изданиях.
Энтропия, также как внутренняя энергия и энтальпия, является функцией состояния, поэтому изменение энтропии системы в процессе не зависит от его пути и определяется только начальным и конечным состоянием системы. Изменение энтропии в ходе химической реакции (2.10) может быть найдено, как разность суммы энтропий продуктов реакции и суммы энтропий исходных веществ
![]()
Вопрос 6
Энергия Гиббса – термодинамическая функция состояния системы при T=const, p=const [G:Дж/моль]
dG=dH-dS*T.
Если dG<0 то процесс протекает,
Если dG>0 то процесс не протекает,
Если dG=0 то система в равновесии.
Вопрос 7
Скорость химической реакции определяется числом элементарных актов между молекулами в единицу времени.
V=dn/dt*v-для гомогенных систем.
V=(dn/dt)*1/S-для гетерогенных систем.
Средняя скорость для гомогенной реакции – отношение убыли концентрации исходных в-в в единицу времени.
Истинная скорость определяется изменением концентрации в данный момент времени.
V=dc/dt.
Вопрос 8
Зависимость скорости реакции от температуры описывается правилом Вант-Гоффа:
Ɣ – температрный коэффициент, показывающий во сколько раз увелич скорость реакции при повышении T на 10 градусов
Уравнение Аррениуса:
K=A*e(-Eакт/RT)
Энергия активации это энергия, которую необходимо сообщить молекуле чтобы сделать ее активной.
Постоянная А=к (при Еакт=0)
Вопрос 9
Реакции делятся на два типа: 1)обратимые, 2)необратимые. К необратимым относятся реакции, при которых исходные в-ва полностью уходят. Остальные реакции протекают в 2х взаимопротивоположных направлениях до установления равновесия, при которых скорости прямой и обратной реакции равны.
аА+вВ=мМ+nN
Константа хим равновесия – термодинамич. Ф., которая характеризует быстроту протекания реакции (10(-10) до 10(10). Зависит от природы веществ, от Т и НЕ зависит от их концентраций, давления и катализатора.
Принцип Ле-Шателье: При повышении давления равновесие смещается в сторону уменьшения давления (меньшего числа молекул).
