
- •Вопрос 1
- •Вопрос 2
- •Вопрос 3
- •Вопрос 4
- •Вопрос 5
- •Вопрос 6
- •Вопрос 7
- •Вопрос 8
- •Вопрос 9
- •Вопрос 10
- •Вопрос 11
- •Вопрос 13.
- •Вопрос 14
- •Вопрос 15
- •Вопрос 16
- •Вопрос 17
- •Вопрос 18
- •Вопрос 19
- •Вопрос 20
- •Вопрос 21
- •Вопрос 22
- •Вопрос 23
- •Вопрос 24
- •Вопрос 25
- •Вопрос 26
- •Вопрос 27
- •Вопрос 28
- •Вопрос 29
- •Вопрос 30 Защитные покрытия обеспечивают изоляцию металла от внешней среды и таким образом препятствуют протеканию коррозии. Покрытия делятся на металлические и неметаллические.
Вопрос 23
ПР (произведение растворимости) - это величина, представляющая собой произведение концентраций ионов труднорастворимого электролита в растворе. Эта величина характеризует растворимость данного вещества: чем больше растворимость, тем больше концентрация ионов и, следовательно, ПР. ПР применяется для растворов труднорастворимых солей (практически все соли являются сильными электролитами); для хорошо растворимых сильных электролитов вместо ПР используют произведение активности ионов. Для малорастворимых электролитов - это постоянная величина. ПР не зависит от концентрации. ПР зависит от температуры: с ростом температуры она обычно увеличивается, т.к. возрастает растворимость. На практике можно с помощью ПР вычислить растворимость (данные о ПР приводятся в справочниках). В общем виде: ПР = (nS)^n * (mS)^m = (mn)S^(m+n), где S - растворимость вещества, n и m - коэффициенты в уравнении диссоциации (количество ионов, образовавшихся при диссоциации 1 молекулы данного электролита).
Введение одноименного иона снижает степень диссоциации электролита. Растворимость труднорастворимого электролита от введения в раствор одноименных ионов уменьшается.
Вопрос 24
Вопрос 25
Гальванические элементы – химический источник тока, в котором реагенты расходуются в ходе его работы. После исчерпания реагентов гальванический элемент не может быть более использован. В основе действия гальванического элемента может быть химический процесс или процесс выравнивания концентраций двух электролитов – растворов одного и того же вещества. По этому критерию гальванические элементы делятся на химические и концентрационные.
Аккумуляторы отличаются от гальванических элементов тем, что после исчерпания реагентов работоспособность аккумулятора может быть восстановлена пропусканием тока в направлении, обратном направлению тока при работе. Процесс выработки электрической энергии носит название разряд, а процесс восстановления работоспособности аккумулятора – заряд. При разряде химическая энергия превращается в электрическую, а при заряде – электрическая в химическую. Аккумулятор это гальванический элемент многоразового использования.
Топливные элементы – это гальванические элементы, требующие в процессе работы расхода окислителя и восстановителя, подаваемых извне. В качестве восстановителя может быть использован водород, природный газ, метанол и др., в качестве окислителя обычно применяют кислород воздуха. Наиболее разработана конструкция топливного элемента, работающего на водороде и кислороде.
В электрохимии процессы окисления носят название анодных процессов, а электрод, на котором протекает окисление называется анод; соответственно, процессы восстановления называются катодными процессами, а электрод, на котором проходит восстановление носит название катод.
Электродным потенциалом называется величина, равная ЭДС гальванического элемента, составленного из данного электрода и стандартного водородного электрода.
ЭДС электрохимического элемента равна разности электродных потенциалов:
Е = φ1 - φ2
Электродный потенциал электрода считается положительным, если в гальваническом элементе со стандартным водородным электродом данный электрод является катодом, и отрицательным - если анодом.
ЭДС «работающего» гальванического элемента должна быть положительна; иначе электродные процессы идут в обратном направлении (происходит переполюсовка электродов).
Уравнение Нернста — уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, истандартными электродными потенциалами окислительно-восстановительных пар
![]() ,
,
где
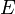 —
электродный
потенциал, E0 —
стандартный электродный потенциал,
измеряется в вольтах;
—
электродный
потенциал, E0 —
стандартный электродный потенциал,
измеряется в вольтах;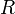 — универсальная
газовая постоянная, равная 8.31
Дж/(моль·K);
— универсальная
газовая постоянная, равная 8.31
Дж/(моль·K);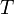 —
абсолютная
температура;
—
абсолютная
температура; — число
Фарадея, равное 96485,35 Кл/моль;
— число
Фарадея, равное 96485,35 Кл/моль;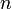 —
число моль электронов,
участвующих в процессе;
—
число моль электронов,
участвующих в процессе;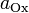 и
и 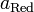 — активности соответственно окисленной и восстановленной форм
вещества, участвующего в полуреакции.
— активности соответственно окисленной и восстановленной форм
вещества, участвующего в полуреакции.
Если в формулу Нернста подставить числовые значения констант R и F и перейти от натуральных логарифмов к десятичным, то при T = 298K получим
![]()
