
- •Вопрос 1
- •Вопрос 2
- •Вопрос 3
- •Вопрос 4
- •Вопрос 5
- •Вопрос 6
- •Вопрос 7
- •Вопрос 8
- •Вопрос 9
- •Вопрос 10
- •Вопрос 11
- •Вопрос 13.
- •Вопрос 14
- •Вопрос 15
- •Вопрос 16
- •Вопрос 17
- •Вопрос 18
- •Вопрос 19
- •Вопрос 20
- •Вопрос 21
- •Вопрос 22
- •Вопрос 23
- •Вопрос 24
- •Вопрос 25
- •Вопрос 26
- •Вопрос 27
- •Вопрос 28
- •Вопрос 29
- •Вопрос 30 Защитные покрытия обеспечивают изоляцию металла от внешней среды и таким образом препятствуют протеканию коррозии. Покрытия делятся на металлические и неметаллические.
Вопрос 13.
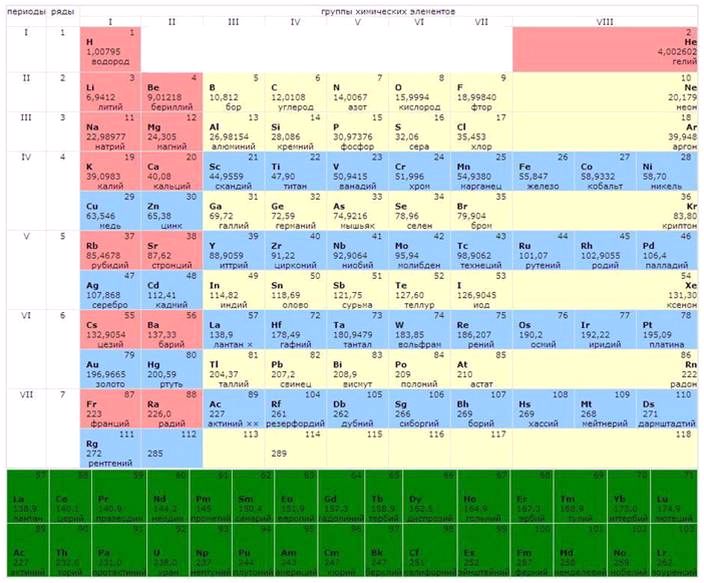
Переодический закон:свойства химических элементов, а также формы и свойства образуемых ими простых веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов».
В периодах отначала к периода к концу (слева направо) усиливаются кислотные (неметаллические) свойства и ослабевают основные (металлические) свойства в связи с увеличением количества электронов на внешнем электронном уровне. В группах от начала к концу (сверху вниз) усиливаются металлические (основные) свойства и ослабевают неметаллические (кислотные свойства) в связи с увеличением электронных уровней и меньшим притяжение электронов внешнего уровня к ядру.
Короткопериодный вариант состоит из десяти рядов, причем каждый нечетный ряд ( за исключением первого) состоит из восьми элементов. Первые два элемента четных рядов больших периодов и все элементы ( за исключением первых двух) нечетных рядов этих же периодов входят в главные подгруппы. Поэтому в периодической системе восемь элементов каждого периода образуют восемь главных подгрупп, а остальные десять элементов каждого большого периода - восемь побочных подгрупп; при этом девятый и десятый элементы объединяются с восьмым, вследствие чего восьмая побочная группа содержит триады элементов.
Вопрос 14
Ковалентная связь (атомная связь) — химическая связь, образованная перекрытием (обобществлением) пары валентных электронных облаков. Обеспечивающие связь электронные облака (электроны) называются общей электронной парой.
Свойства: Направленность связи обусловливает молекулярное строение веществ и геометрическую форму их молекул. Углы между двумя связями называют валентными.
Насыщаемость — способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей.
Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов. По этому признаку ковалентные связи подразделяются на неполярные и полярные.
Вопрос 15
Полярность обусловлена распределением электронной плотности общей электронной пары между ядрами взаимодействующих атомов. Если взаимодействующее пары обладают одинвковой электроотрицательностью, то электронная плотность общей электронной пары равномерно распределяется между атомами. И образующаяся хим.связь – неполярная. Это возможно лишь тогда, когда связь образуется между атомами одного хим. Элемента. Если электроотрицаительность у атомов разная то электронная плотность общей электронной пары смещается к более электроотрицательному элементу.
Дипрльный момент – качественная характеристика полярности связи
Вопрос 16
Вопрос 17
Ионная связь — прочная химическая связь, образующаяся между атомами с большой разностью (>1,7 по шкале Полинга) электроотрицательностей, при которой общая электронная параполностью переходит к атому с большей электроотрицательностью.Это притяжение ионов как разноименно заряженных тел. Ионная связь - это химическая связь, образованная за счет электростатического притяжения между катионами и анионами.
Механизм образования ионной связи можно рассмотреть на примере реакции между натрием и хлором. Атом щелочного металла легко теряет электрон, а атом галогена - приобретает. В результате этого возникает катион натрия и хлорид-ион. Они образуют соединение за счет электростатического притяжения между ними.
Взаимодействие между катионами и анионами не зависит от направления, поэтому о ионной связи говорят как о ненаправленной. Каждый катион может притягивать любое число анионов, и наоборот. Вот почему ионная связь является ненасыщенной. Число взаимодействий между ионами в твердом состоянии ограничивается лишь размерами кристалла. Поэтому "молекулой" ионного соединения следует считать весь кристалл.
