
- •По дисциплине «общая и неорганическая химия»
- •Строение комплексных соединений
- •Номенклатура комплексных соединений
- •Классификация комплексных соединений
- •Природа химической связи в комплексных соединениях
- •Метод валентных связей
- •Типы гибридизаций и геометрические конфигурации некоторых комплексов
- •Оптические свойства комплексных соединений
- •Устойчивость комплексных соединений
- •Примеры решения задач
- •Таким образом, в данном комплексном ионе имеет место sp3-гибридизация ао, в результате которой связи направлены к вершинам тетраэдра и ион [HgCl4]2– имеет тетраэдрическую структуру.
- •Многовариантное задание № 1
- •Многовариантное задание № 2
- •Окраска вещества при поглощении веществом определённой части спектра
- •Константы нестойкости некоторых комплексных ионов при 25 с
- •Произведения растворимости малорастворимых электролитов при 25 °с
- •1 62600, Г. Череповец, пр. Луначарского, 5.
Оптические свойства комплексных соединений
Если на dγ-подуровне в случае октаэдрического поля лигандов (или на dε-подуровне для тетраэдрического поля) есть вакантная (свободная) АО, то при поглощении комплексным ионом кванта света возможен переход электрона с нижнего энергетического подуровня на верхний (для октаэдрического поля – это переход с dε-подуровня на dγ). Такого рода переходы определяют наличие окраски у КС, так как энергия поглощаемого кванта света равна энергии расщепления. В расчете на 1 моль поглощающего вещества справедливо соотношение, Дж/моль:
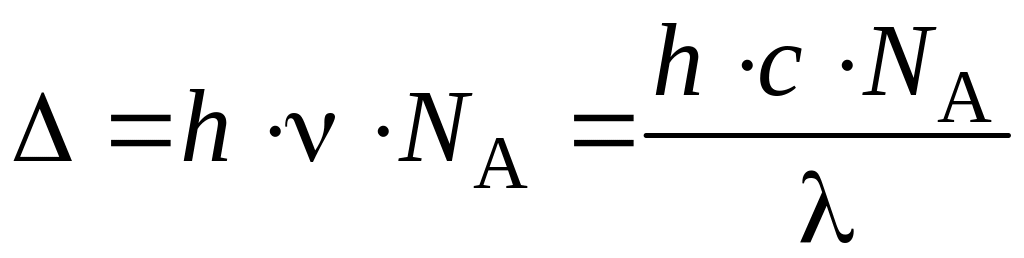 , (2)
, (2)
где h – постоянная Планка (h = 6,63 10–34 Дж с); с – скорость света (с = 3108 м/с); NА – постоянная Авогадро (NА = 6, 02 1023 моль–1); – длина волны поглощаемого света, м.
При поглощении света с длиной волны, соответствующей определенной части спектра, вещество оказывается окрашенным в соответствующий цвет (см. приложение, табл. 1).
При замене в комплексе одних лигандов на другие, расположенные в спектрохимическом ряду правее (т.е. обладающие большей силой поля), значение энергии расщепления Δ возрастает и комплекс начинает поглощать лучи света с меньшей длиной волны. Это изменяет его окраску.
Например, ион [Co(ONO)(NH3)5]2+ – красного цвета, а [Co(NO2)(NH3)5]2+ – желтого; у комплексов меди (II) при переходе от [CuCl4]2+ к [Cu(H2O)4]4+ и к [Cu(NH3)4]2+ цвет изменяется от зелёного через голубой на сине-фиолетовый.
Сила поля четырех лигандов меньше силы октаэдрического поля, поэтому параметр расщепления тетраэдрическим полем всегда меньше, чем октаэдрическим. Для 3d-элементов с незаполненным 3d-подуровнем образование тетраэдрических комплексов происходит только в слабом поле лигандов (в сильном поле формируются плоскоквадратные комплексы, КЧ = 4). При конфигурации 3d10 всегда образуются тетраэдрические комплексы.
Устойчивость комплексных соединений
При характеристике устойчивости комплексов используют такие понятия, как «устойчивость» и «инертность» или «неустойчивость» и «лабильность».
Устойчивость комплекса является его термодинамической характеристикой и связана с энергиями образующихся связей и с изменением энтропии при комплексообразовании.
Инертность и, наоборот, лабильность комплекса являются его кинетическими характеристиками, зависящими от скоростей замещения его лигандов. Устойчивые комплексы могут быть инертными и лабильными. Например, ионы [Cr(H2O)6]3+ и [Fe(H2O)6]3+ имеют близкие значения энергии связи, т.е. обладают почти одинаковой устойчивостью, но первый комплекс инертен и обменивает лиганды медленно, а второй лабилен, так как обменивает лиганды быстро. Неустойчивые комплексы чаще всего являются лабильными.
КС могут быть как электролитами, так и неэлектролитами. В первом случае они содержат комплексный катион или анион, т. е. являются солью, кислотой или основанием, а во втором – содержат только внутреннюю сферу, т. е. относятся к классу нейтральных комплексов.
При растворении в воде КС, имеющие внешнюю сферу, диссоциируют как сильные электролиты с образованием комплексного иона, состоящего из частиц внутренней сферы, и ионов внешней сферы. Этот процесс называется первичной диссоциацией. Например:
К4[Fe(CN)6] 4К+ + [Fe(CN)6]4–
Наряду с этим процессом, как правило, протекает обратимая ступенчатая диссоциация внутренней сферы, которую называют вторич-
ной диссоциацией. Так, для иона [Fe(CN)6]4– этот процесс идет по следующим ступеням:
первая ступень: [Fe(CN)6]4– ↔ CN– + [Fe(CN)5]3– ;
вторая ступень: [Fe(CN)5]3– ↔ CN– + [Fe(CN)4]2– и т.д.
Подобная запись уравнений вторичной диссоциации комплексов не отражает одного из важных условий протекания процессов в водных растворах: КЧ комплексообразователя должно сохраняться постоянным. Поэтому при отрыве лиганда от комплексного иона его место обязательно заполняется молекулой воды, а процесс вторичной диссоциации правильнее записывать следующим образом:
первая ступень: [Fe(CN)6]4– + Н2О ↔ CN– + [Fe(CN)5(Н2О)]3– ;
вторая ступень: [Fe(CN)5(Н2О)]3– + Н2О ↔ CN– + [Fe(CN)4(Н2О)2]2– .
Количественной характеристикой прочности комплексного иона является константа равновесия процесса вторичной диссоциации, которую называют константой нестойкости Kнест. Например, для иона [Fe(CN)6]4– константы нестойкости первой и второй ступеней выражаются уравнениями:
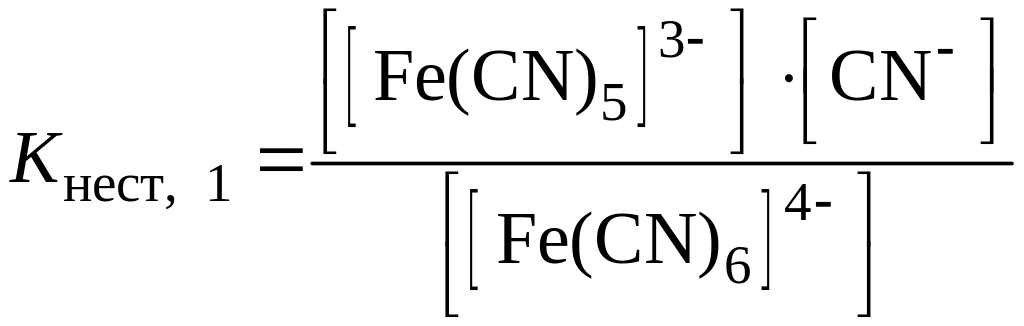 ;
;
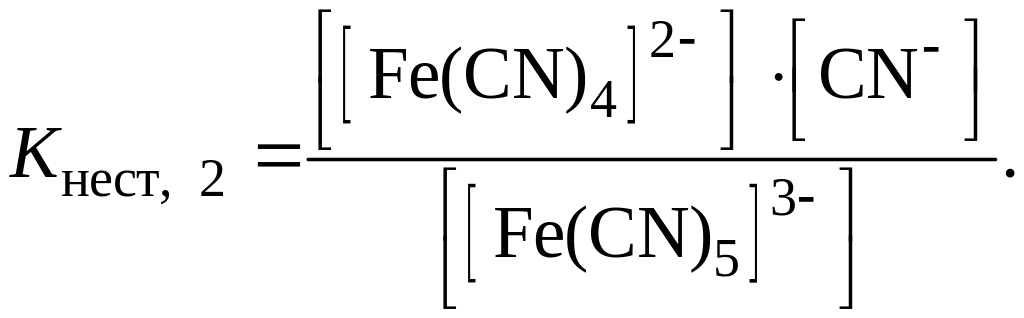
Определение ступенчатых констант нестойкости представляет большие экспериментальные и расчетные трудности, поэтому чаще пользуются величиной общей константы нестойкости Kнест, которая характеризует суммарное равновесие вторичной диссоциации. Например, для иона [Fe(CN)6]4–
[Fe(CN)6]4–
↔ 6CN–
+ Fe2+,
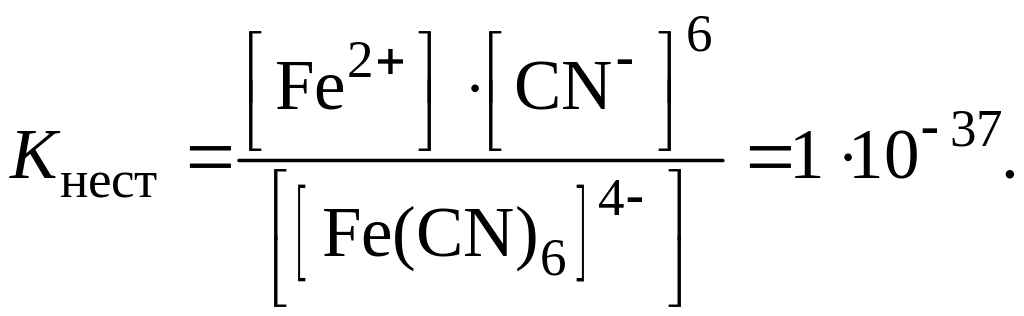
Общая константа нестойкости равна произведению констант нестойкости всех ступеней:
Kнест = Kнест, 1 · Kнест, 2 · Kнест, 3 · Kнест, n. (3)
Иногда вместо констант нестойкости пользуются обратными величинами – константами устойчивости Kуст, относящимися к процессу образования комплексного иона:
Kнест = 1/Kуст . (4)
Устойчивость комплексных ионов оценивают, сравнивая их ступенчатые константы нестойкости. Если комплексы имеют одинаковое число лигандов, то их устойчивость можно определить по общей константе нестойкости: чем меньше Kнест, тем более устойчив комплексный ион. Значения Kнест некоторых комплексов приведены в табл. 2 приложения.
Прочность и состав образующихся комплексных соединений зависит от многих факторов. Помимо природы реагирующих веществ влияние оказывают и условия проведения реакции. В большинстве случаев в малополярных растворителях прочность комплексных соединений выше, чем в полярных, так как в них взаимодействие между ионами комплексообразователя и молекулами растворителя ослаблено. На устойчивость комплексных ионов может влиять и рН среды.
Сопоставление Kнест комплексов для реагента и для продукта (при постоянном КЧ) позволяет установить направление смещения равновесия реакции обмена лигандами в растворе. Например, сравнив для процесса
K2[PtCl4] + 4KI ↔ K2[PtI4] + 4KCl
константы нестойкости ионов [PtCl4]2– и [PtI4]2–, которые соответственно равны 110-16 и 110-31, видно, что комплексный ион-продукт намного устойчивее комплекса-реагента. Следовательно, равновесие такого процесса сильно сдвинуто вправо, т. е. данная реакция протекает в прямом направлении.
Разрушение комплекса может произойти при снижении концентрации одного из компонентов, входящих в состав комплексного иона, если, например, в раствор внесено вещество, с которым лиганды связываются более прочно, чем они были связаны с комплексообразователем.
Комплексные соединения с малоустойчивой внутренней сферой часто называют двойными солями. В твердом состоянии они имеют координационную структуру, а в растворе полностью распадаются на составные ионы. Например:
К2[CuCl4] ↔ 2K+ + Cu2+ + 4Cl–.
Двойные соли можно обозначать перечислением формул простых солей, разделяя их точкой. Например, соль К2[CuCl4] из-за высокого значения константы нестойкости иона [CuCl4]2– часто представляют формулой CuCl2 · 2КCl. Таким же образом обозначают и кристаллогидраты, являющиеся комплексными соединениями. Различие между кристаллогидратами, двойными солями и комплексными соединениями заключается в их относительной прочности. Двойные соли при диссоциации дают все те ионы, которые находятся в растворах простых солей.
