
- •По дисциплине «общая и неорганическая химия»
- •Строение комплексных соединений
- •Номенклатура комплексных соединений
- •Классификация комплексных соединений
- •Природа химической связи в комплексных соединениях
- •Метод валентных связей
- •Типы гибридизаций и геометрические конфигурации некоторых комплексов
- •Оптические свойства комплексных соединений
- •Устойчивость комплексных соединений
- •Примеры решения задач
- •Таким образом, в данном комплексном ионе имеет место sp3-гибридизация ао, в результате которой связи направлены к вершинам тетраэдра и ион [HgCl4]2– имеет тетраэдрическую структуру.
- •Многовариантное задание № 1
- •Многовариантное задание № 2
- •Окраска вещества при поглощении веществом определённой части спектра
- •Константы нестойкости некоторых комплексных ионов при 25 с
- •Произведения растворимости малорастворимых электролитов при 25 °с
- •1 62600, Г. Череповец, пр. Луначарского, 5.
Классификация комплексных соединений
Комплексные соединения очень разнообразны по строению и свойствам, поэтому применяющиеся системы классификации КС основываются на различных принципах:
1. По принадлежности к определенному классу химических соединений различают:
а) комплексные кислоты – Н[AuCl4] тетрахлорозолотая (III) кислота;
б) комплексные основания – [Cu(NH3)4](OH)2 гидроксид тетраамминмеди (II);
в) комплексные соли – K4[Fe(CN)6] гексацианоферрат (II) калия.
2. По природе лигандов:
а) аквакомплексы (лиганды – молекулы воды) [Co(Н2О)4](NO3)2;
б) аммиакаты (лиганды – молекулы аммиака) [Ag(NH3)2]Cl;
в) ацидокомплексы (лиганды – анионы кислот) Na3[AlF6];
г) гидроксокомплексы (лиганды – гидроксогруппы) K3[Al(OH)6];
д) смешанного типа (содержатся лиганды нескольких видов) [Co(NH3)4Cl2].
3. По знаку заряда комплекса:
а) катионные [Zn(NH3)4]2+Cl ;
б) анионные Li+[AlH4]– ;
в) нейтральные (без внешней сферы) [Pt(NH3)2Cl2]0;
г) бикомплексы [Co(NH3)6][Fe(CN)6].
4. По внутренней структуре комплексного соединения:
а) циклические или хелатные (клешневидные) – содержат би- и полидентатные лиганды:
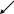 NH2
– СH2
NH2
– СH2
 Ме
Ме
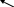 NH2
– СH2
NH2
– СH2
б) одноядерные комплексы – внутренняя сфера имеет один центральный атом и некоторое число лигандов, например: [SbF6]–;
в) многоядерные комплексы – содержат несколько центральных атомов, например: [Os3(CO)12] – трехядерный комплекс. Многоядерные комплексы также делят на комплексы с мостиковыми лигандами, связывающие одновременно два комплексообразователя (например, в соединении К4[(C2O4)2Co(OH)2Co(C2O4)2]), и кластеры, в которых центральные атомы связаны между собой непосредственно – K4[Cl4Re – ReCl4] (иначе K4[Re2Cl8]).
Природа химической связи в комплексных соединениях
Механизм образования комплексных соединений, т. е. природа связи между комплексообразователем и лигандами, описывается с помощью различных квантово-механических методов, из которых самыми распространенными являются метод валентных связей (МВС) и теория поля лигандов (ТПЛ).
Метод валентных связей
Взаимодействие между комплексообразователем и лигандами осуществляется согласно следующим положениям:
1. Комплексообразователь и лиганды образуют ковалентные связи по донорно-акцепторному механизму. Лиганды являются донорами, а центральный атом – акцептором электронов. Возникающие таким образом связи относятся к -типу и называются координационными;
2. Атомные орбитали (АО) центрального атома гибридизируются в зависимости от его электронной структуры, а также числа и природы лигандов. Тип гидридизации определяет геометрическое строение комплекса. Наиболее распространенные типы гибридизаций приведены в табл. 1. Собственные электронные пары комплексообразователя изображены сплошными стрелками, а донорные электронные пары лигандов - пунктирными;
3. Магнитные свойства комплекса связаны с наличием (парамагнетизм) или отсутствием (диамагнетизм) неспаренных электронов во внутренней сфере КС;
4. Кроме -связей между комплексообразователем и лигандами могут возникать -связи, в которых центральный атом – донор, а лиганды – акцепторы.
Таблица 1
