
- •(Для студентов заочной формы обучения)
- •Часть 1
- •Введение
- •Основные законы химии Краткие теоретические сведения
- •Определение z* и расчет мэ простых и сложных веществ
- •Математически закон эквивалентов для условной реакции вида
- •Примеры решения задач
- •По закону эквивалентов [из формулы (13)]
- •В любом оксиде с.О. Кислорода равна –2, тогда по формуле (9)
- •Следовательно,
- •Строение атомов и свойства химических элементов Краткие теоретические сведения
- •Основная масса атома сосредоточена в ядре и характеризуется массовым числом а, которое равно сумме числа протонов z и числа нейтронов n:
- •Основные характеристики подуровней
- •Зависимость некоторых свойств элементов и их соединений от z
- •Относительная электроотрицательность некоторых элементов
- •Примеры решения задач
- •Химическая связь и строение молекул Краткие теоретические сведения
- •Разрыв связи в молекуле может быть осуществлен:
- •Виды гибридизаций ао и геометрические параметры частиц
- •Строение и ожидаемая полярность молекул
- •Примеры решения задач
- •Согласно табл. 4, эо атомов хлора и йода соответственно равны 2,83 и 2,21. Находим разность эо атомов:
- •По рис. 1 определяем си связи. Си 5 %. Тогда
- •Список литературы
Виды гибридизаций ао и геометрические параметры частиц
Тип гибридизации |
Расположение гибридных АО |
Угол между связями |
Коли- чество Ё |
Геометрическая форма и состав молекулы |
Пример |
sp |
Линейное |
180 |
0 |
Линейная АВ2 |
BeCl2 |
sd |
Линейное |
90 |
0 |
Угловая АВ2 |
SrCl2 |
sp2 или sd2 |
Треугольное |
120 Уменьшается |
0 1 |
Треугольник АВ3 Угловая АВ2Ё |
BF3 SnCl2 |
sp3 или sd3 |
Тетраэд-рическое |
10928/ Уменьшается Уменьшается |
0 1 2 |
Тетраэдр АВ4 Тригональная пирамида АВ3Ё Угловая АВ2Ё2 |
CH4 NF3 H2O |
sp3d |
Тригональнобипирамидальное |
90 и 120
–
180 и 90 180 |
0
1
2 3 |
Тригональная бипирамида АВ5 Неправильный тетраэдр АВ4Ё Т-образная АВ3Ё2 Линейная АВ2Ё3 |
PCl5
SF4 ClF3 XeF2 |
sp3d2 |
Октаэдри-ческое |
90 90
90 |
0 1
2 |
Октаэдр АВ6 Тригональная бипирамида АВ5Ё Квадрат АВ4Ё2 |
SF6
SbF XeF4 |
sp3d3 или sp3d2f |
Пентагональнобипирамидальное |
–
– |
0
1 |
Пентагональная бипирамида АВ7 Неправильный октаэдр АВ6Ё |
IF7 XeF6 |
При образовании КС между атомами одинаковой химической природы (например, в молекулах Н2, Cl2, О2) общее электронное облако располагается в пространстве между ядрами симметрично. Такую КС называют неполярной. Если же связь образуют атомы разных элементов, то общие электроны смещаются в сторону атома с большим значением ЭО и такую КС называют полярной. Смещение электронной плотности в область более электроотрицательного элемента приводит к возникновению в его околоядерном пространстве эффективного отрицательного заряда q–, и, наоборот, недостаток электронной плотности у взаимодействующего с ним атома ведет к появлению эффективного положительного заряда q+. Такая система представляет собой электрический диполь, поэтому мерой полярности КС является величина электрического момента диполя (ЭМД) связи А–В,
Кл · м, которую можно оценить по формуле
![]() ,
(16)
,
(16)
где l – длина диполя. При оценочных расчетах длину диполя можно принимать равной длине связи.
ЭМД можно также выражать в дебаях (D): 1 D =
= 3,33 10-30 Кл м.
Полярную КС характеризуют при помощи степени ионности (СИ) и степени ковалентности (СК) связи, которые в сумме составляют 100 % (СИ + СК = 100 %). СИ показывает долю (%) смещенности общей электронной пары в область атома с большим значением ЭО. Ее можно оценить по формуле
![]() %
, (17)
%
, (17)
где е – заряд электрона (е = 1,602 10-19 Кл).
Из уравнения (17) следует, что с увеличением ЭО взаимодействующих атомов СИ связи увеличивается, а СК связи уменьшается. Количественная связь между СИ и ЭО приведена на рис. 1.
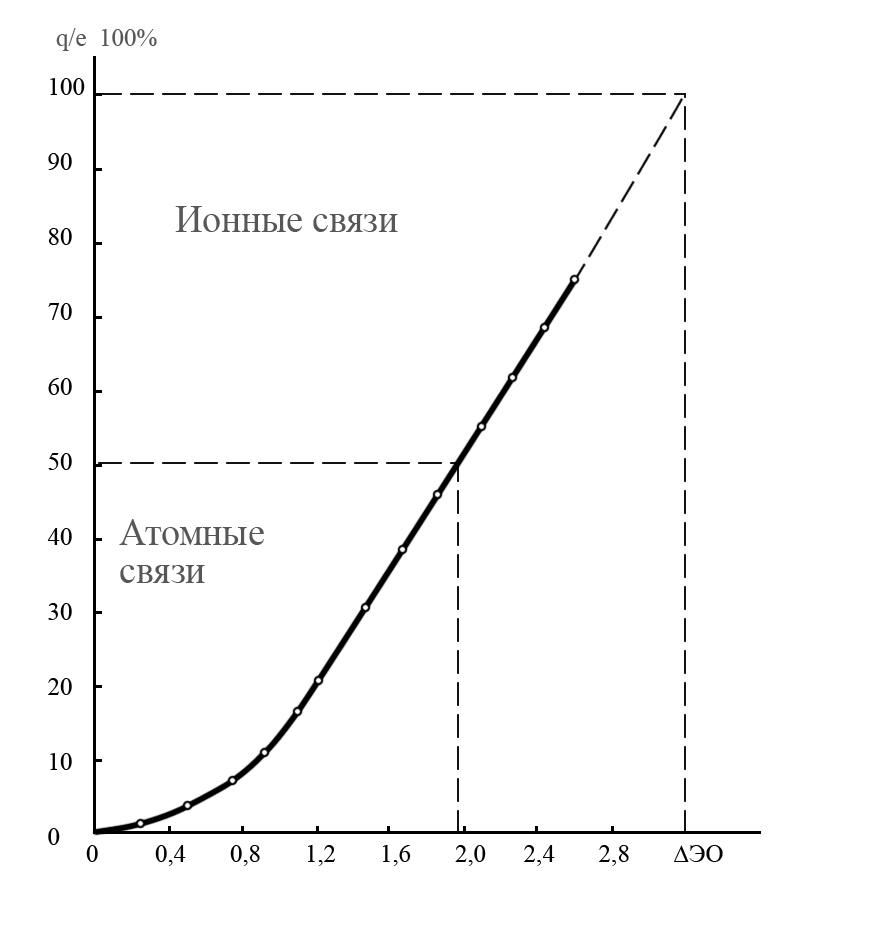
Рис. 1. Зависимость СИ от ΔЭО
А–В – величина векторная, направленная от положительного полюса диполя к отрицательному. Например, в молекуле HF НF будет направлен от атома водорода к атому фтора, так как ЭО(F) >
> ЭО(Н) (см. табл. 4).
Молекулы
с полярными КС, в зависимости от
распределения суммарной электронной
плотности всех связей в молекуле, могут
быть полярными
и неполярными.
Молекула считается неполярной, если
ЭМД молекулы
![]() ,
который определяется путем геометрического
сложения ЭМД всех ее связей, равен нулю.
,
который определяется путем геометрического
сложения ЭМД всех ее связей, равен нулю.
Например,
в молекуле СО2
(см. рис. 2, б), которая имеет симметричное
линейное строение, ЭМД отдельных связей
направлены в противоположные стороны
и при их геометрическом сложении
полностью компенсируют друг друга.
Поэтому ![]() =
0 и молекула СО2
является неполярной.
=
0 и молекула СО2
является неполярной.
В
полярной молекуле
>
0, то есть
геометрическое сложение векторов ЭМД
связей дает конечный вектор
.
Например, в угловой молекуле Н2О
(см. рис. 2, а) полярные связи располагаются
под углом 104,5.
При геометрическом сложении ЭМД связей
не происходит их взаимной компенсации
(![]() >
0, молекула
полярная).
>
0, молекула
полярная).


а) б)
Рис. 2. Векторное сложение ЭМД на примере молекул Н2О и СО2
В табл. 6 приведены предполагаемые полярности молекул различной геометрической формы.
По методу молекулярных орбиталей (ММО) молекула рассматривается как единое целое – ядра атомов составляют каркас молекулы, а электроны атомов становятся общими для всей молекулы и располагаются на молекулярных орбиталях (МО). Метод основан на следующих положениях:
1. МО образуются путем линейной комбинации АО, т. е. путем сложения или вычитания исходных АО – метод линейной комбинации АО (ЛКАО).
По методу ЛКАО, если МО образуется в результате сложения АО, её энергия будет ниже, чем энергия исходных АО. Такая орбиталь называется связывающей МО (обозначается , или в зависимости от типа перекрывания электронных облаков). В случае вычитания АО возникающая МО имеет более высокое значение энергии, чем исходная АО, и называется разрыхляющей (обозначается *, * или *). Электрон, находящийся на связывающей МО, обеспечивает связь между атомами, а электрон, находящийся на разрыхляющей МО, ослабляет связь между атомами;
2. При заполнении электронами МО выполняются принцип Паули и правило Гунда;
3. Число МО равно числу взаимодействующих АО реагирующих атомов. Например, при взаимодействии двух АО со стороны каждого атома в молекуле типа А2 образуется четыре МО, из которых две – связывающие и две – разрыхляющие;
4.
По возрастанию энергий МО двухатомных
молекул первого периода и начала второго
периода (до N2
включительно) можно расположить в
следующий ряд: σ![]() <
σ
<
σ![]() <
σ
<
σ![]() <
σ
<
σ![]() <
π
<
π![]() =
=
=
π![]() <
σ
<
σ![]() <
π
<
π![]() =
π
=
π![]() <
σ
<
σ![]() .
.
МО двухатомных молекул конца второго периода (от О2 и далее) по возрастанию энергий располагаются в несколько иной ряд:
σ < σ < σ < σ < σ < π = π < π = π < σ .
Таблица 6
