
- •(Для студентов заочной формы обучения)
- •Часть 1
- •Введение
- •Основные законы химии Краткие теоретические сведения
- •Определение z* и расчет мэ простых и сложных веществ
- •Математически закон эквивалентов для условной реакции вида
- •Примеры решения задач
- •По закону эквивалентов [из формулы (13)]
- •В любом оксиде с.О. Кислорода равна –2, тогда по формуле (9)
- •Следовательно,
- •Строение атомов и свойства химических элементов Краткие теоретические сведения
- •Основная масса атома сосредоточена в ядре и характеризуется массовым числом а, которое равно сумме числа протонов z и числа нейтронов n:
- •Основные характеристики подуровней
- •Зависимость некоторых свойств элементов и их соединений от z
- •Относительная электроотрицательность некоторых элементов
- •Примеры решения задач
- •Химическая связь и строение молекул Краткие теоретические сведения
- •Разрыв связи в молекуле может быть осуществлен:
- •Виды гибридизаций ао и геометрические параметры частиц
- •Строение и ожидаемая полярность молекул
- •Примеры решения задач
- •Согласно табл. 4, эо атомов хлора и йода соответственно равны 2,83 и 2,21. Находим разность эо атомов:
- •По рис. 1 определяем си связи. Си 5 %. Тогда
- •Список литературы
Примеры решения задач
Пример 1. Средняя энергия связи N–Н в молекуле NH3 равна 385 кДж/моль. Какое количество энергии необходимо затратить, чтобы разложить на атомы: а) 1 молекулу аммиака; б) 10 г аммиака?
Р е ш е н и е
По формуле (15) найдем энергию образования 1 моль молекул аммиака
![]() кДж/моль.
кДж/моль.
Тогда на разрушение 1 молекулы аммиака понадобится энергия
![]() Дж.
Дж.
Энергия, необходимая для разложения 10 г аммиака, составляет
![]() кДж.
кДж.
Пример
2. Укажите
механизм образования связей, направление
смещения общих электронных пар и способ
перекрывания АО в ионе SiF![]() .
Установите тип гибридизации центрального
атома, форму и полярность молекулы.
.
Установите тип гибридизации центрального
атома, форму и полярность молекулы.
Р е ш е н и е
Ион SiF может быть получен при взаимодействии двух ионов F– c молекулой SiF4. Запишем электронные формулы валентных подуровней взаимодействующих атомов и ионов:
Si: …3s2 3p2 3d 0 F: …2s2 2p5 F– : …2s2 2p6
В основном состоянии атом кремния имеет 2 непарных электрона на 3p подуровне, атом фтора – 1 непарный электрон на 2р подуровне, а ион фтора не имеет непарных электронов. Для образования четырех связей с четырьмя атомами фтора по обменному механизму атому кремния необходимо иметь четыре одноэлектронных АО, поэтому он перейдет в возбужденное состояние
Si + E Si*: … 3s1 3p 3.
Свободные АО 3d-подуровня со стороны Si участвуют в образовании двух связей с ионами F– по донорно-акцепторному механизму, где кремний выполняет роль акцептора, а ионы фтора являются донорами. Таким образом, в частице SiF четыре связи образованы по обменному механизму, а две - по донорно-акцепторному.
По табл. 4 находим ЭО(Si) = 1,74 и ЭО(F) = 4,00. ЭО(F) >
> ЭО(Si), значит, смещение общих электронных пар происходит к атомам F.
Так как все связи в ионе SiF являются одинарными, то по способу перекрывания АО все они являются -связями.
Тип
гибридизации определяем по числу АО
кремния, которые участвовали в образовании
связей независимо от механизма их
возникновения. Со стороны атома Si
связи образованы с участием одной s-,
трех p-
и двух d-АО,
следовательно, тип гибридизации – sp3d
2.
Геометрическая форма – октаэдр (см.
табл. 5), так как все гибридные АО являются
связывающими (количество Ё = 0).
Согласно табл. 6, определяем, что частица
SiF
– неполярная, т. е.
![]() .
.
Пример 3. ЭМД молекулы IСl равен 0,54 D. Определите степень ковалентности связи и длину диполя молекулы.
Р е ш е н и е
Согласно табл. 4, эо атомов хлора и йода соответственно равны 2,83 и 2,21. Находим разность эо атомов:
ЭО(Cl – I) = 2,83 – 2,21 = 0,62.
По рис. 1 определяем си связи. Си 5 %. Тогда
СК = 100 – 5 = 95 %.
По формуле (17) вычисляем эффективные заряды атомов
![]() Кл.
Кл.
В молекуле IСl присутствует только одна связь I – Cl, поэтому ЭМД молекулы и ЭДМ связи совпадают. По формуле (16) оцениваем длину диполя
![]()
Пример 4. Составьте энергетическую диаграмму МО молекулы C2 и определите порядок связи в частице. Каковы ее магнитные свойства?
Р е ш е н и е
Образование химической связи в молекуле C2 может быть представлено следующим образом:
2C: 1s 2 2s 2 2p 5 →
→ C2 ![]()
![]()
![]()
![]()
![]()
![]() .
.
Строим энергетическую диаграмму молекулы (рис. 4), из которой следует, что молекула С2 - диамагнитная (все электроны – спаренные).
Порядок связи оцениваем по формуле (18):
![]() .
.
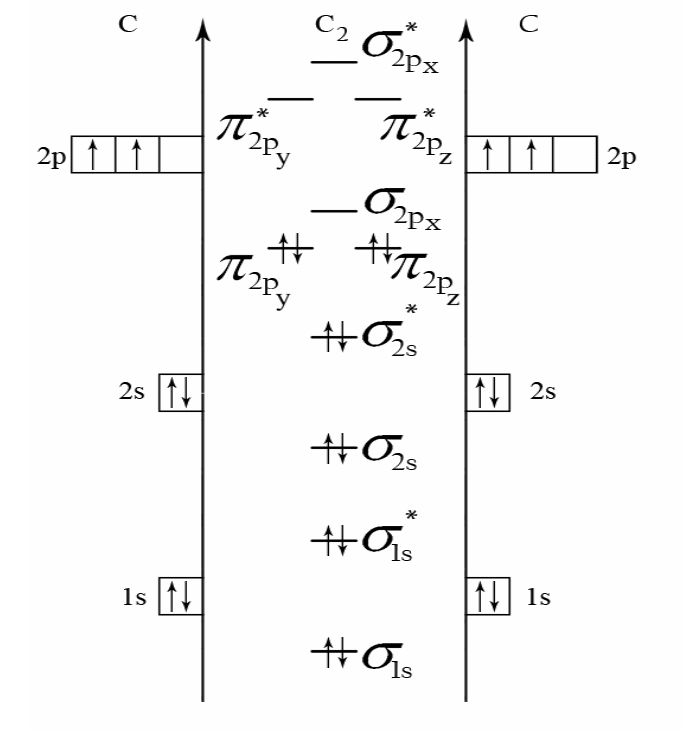

Рис. 4. Энергетическая диаграмма молекулы С2 по ММО
Пример 5. Составьте энергетические диаграммы МО для частиц СN– и NО. Определите магнитные свойства каждой частицы. Какая из них более прочная и почему?
Р е ш е н и е
Ион СN– состоит из атома углерода и иона N–. Электроны в этих частицах распределяются по АО следующим образом:
С: 1s2 2s2 2p2 N–: 1s2 2s2 2p4.
Для распределения электронов по МО необходимо сравнить ЭО атомов. Из табл. 4 выбираем ЭО(С) = 2,5 и ЭО(N) = 3. Поскольку ЭО(С) < ЭО(N), энергия исходных АО иона N– будет меньше, чем у атома углерода. Строим энергетическую диаграмму (см. рис. 5, а). Определяем порядок связи:
n = (10 – 4) /2 = 3.
2s
2px
2px
1s
2s
1s
2pz
2pz
2py
2py
2s
1s
1s
2s
2p
2p
2s
2px
2px
1s
2s
1s
2pz
2pz
2py
2py
2s
1s
1s
2s
2p
2p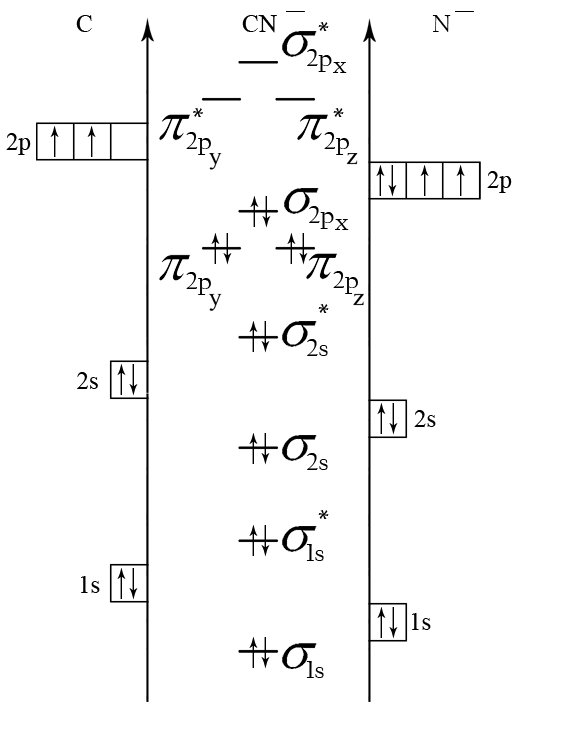

а) б)
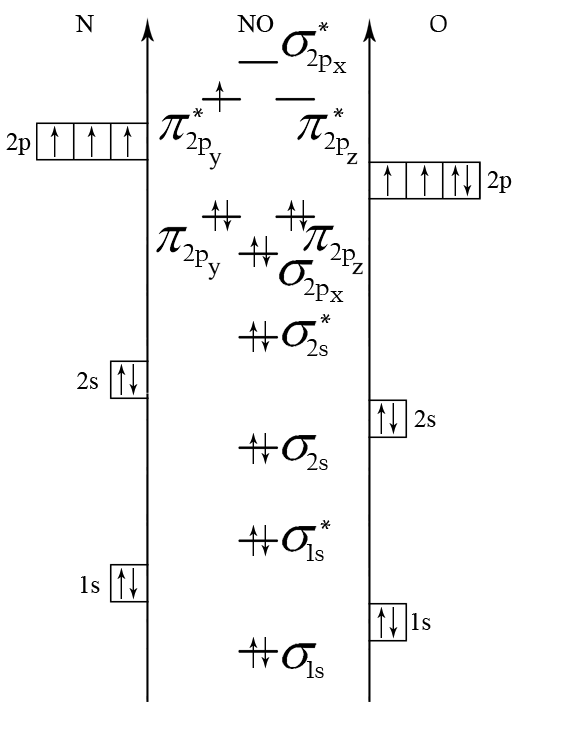
Рис. 5. Энергетические диаграммы СN– и NO
В ионе СN– нет непарных электронов, значит, частица - диамагнитная.
Молекула NО состоит из атомов азота и кислорода. Электроны в этих атомах распределяются по АО следующим образом:
N: 1s2 2s2 2p3 О: 1s2 2s2 2p4.
ЭО(N) = 3, а ЭО(О) = 3,5. Значит, энергия АО кислорода будет меньше, чем у азота. Последовательность возрастания энергии МО принимаем по более ЭО элементу, то есть по кислороду (см. рис. 5, б). Порядок связи в молекуле:
n = (10 – 5)/2 = 2,5.
NО – парамагнетик.
Прочность частиц СN– и NO можно сравнить по величине порядка связи. Чем больше порядок связи, тем больше энергия связи и меньше длина связи. В нашем случае n(CN–) > n(NО), следовательно, частица CN– более прочная, чем NО.
Пример 6. Радиусы ионов Na+ и Cu+ – одинаковые (0,098 нм). Объясните, почему температура плавления NaCl (801 °С) больше температуры плавления CuCl (430 °С).
Р е ш е н и е
При одинаковых зарядах и размерах ионов Na+ и Cu+ различие в их поляризующем действии определяется особенностями их электронного строения.
Запишем электронные формулы ионов:
Cu+: …3s23p63d10 Na+: …2s22p6.
У иона Cu+ ПД выражено сильнее, чем у иона Na+, так как главное квантовое число внешних АО у первого иона равно 3, а у второго – 2. В результате связь в кристаллах CuCl является в меньшей степени ионной, чем в NaCl. Поэтому кристаллическая решетка NaCl более близка к чисто ионному типу и имеет более высокую температуру плавления, чем у CuCl.
Пример 7. CaF2 не распадается на атомы даже при 1000 °С, а CuI2 неустойчив уже при обычной температуре. Чем объяснить различную прочность этих соединений?
Р е ш е н и е
Ион Cu2+, имеющий небольшой радиус (0,08 нм), обладает сильным ПД, а большой по размеру ион I– (r = 0,22 нм) характеризуется высокой поляризуемостью. Поэтому поляризация аниона I– катионом Cu2+ приводит к практически полному переходу электрона от аниона к катиону. В результате ион Cu2+ восстанавливается до Cu+, а ион I– окисляется до свободного йода. Поэтому соединение CuI2 – неустойчивое.
Радиус иона Са2+ составляет 0,104 нм, поэтому он оказывает более слабое ПД на анион, чем ион Cu2+. С другой стороны, поляризуемость иона F–, имеющего сравнительно малый размер
(r = 0,133 нм), значительно меньше, чем у иона I–. При взаимодействии слабополяризующего катиона Са2+ со слабо поляризующимся анионом F– электронные оболочки ионов почти не деформируются, СИ связи практически не снижается, поэтому соединение СаF2 - устойчиво.
Пример 8. H2S при обычной температуре – газ, а вода – жидкость. Чем можно объяснить это различие в физических свойствах?
Р е ш е н и е
Кислород – более ЭО элемент, чем сера. Поэтому между молекулами воды возникают более прочные водородные связи, чем между молекулами сероводорода. Разрыв этих связей требует значительной затраты энергии, что и приводит к аномальному повышению температуры кипения воды.
Пример 9. Ниже приведены Ткип (К) благородных газов:
Не Nе Ar Kr Xe Rn
4,3 27,2 87,3 119,9 165,0 211,2
Чем объясняется повышение Ткип в данном ряду?
Р е ш е н и е
С ростом порядкового номера благородных газов увеличиваются размеры их атомов при сохранении аналогичной структуры внешнего электронного слоя атома. Поэтому поляризуемость атомов возрастает, вследствие чего возрастают и силы межмолекулярного взаимодействия между ними. Отрыв атомов друг от друга, происходящий при переходе вещества из жидкого в газообразное состояние, требует все большей затраты энергии. Это и приводит к повышению температуры кипения.
