
- •Практические работы Работа 1
- •Реагенты
- •Реагенты
- •Работа 3 Определение фосфора в виде фосфорномолнбденовой сини
- •Реагенты
- •Работа 4 Определение марганца формальдоксимом
- •Реагенты
- •Работа 5 Определение титана в виде пероксидного комплекса
- •Реагенты
- •Работа 6 Определение хрома дифенилкарбазидом
- •Аппаратура и реактивы
- •Выполнение работы.
Общие указания
При выполнении практических работ необходимо руководствоваться перечисленными ниже рекомендациями.
1. Внимательно изучить разделы пособия, касающиеся выполняемой работы.
2. Строго следовать методике приготовления растворов, так как рекомендуемые условия получения фотометрируемого соединения (кислотность растворов, концентрации реагентов, порядок их прибавления и т. п.) оптимизированы. При приготовлении растворов объемы стандартного раствора определяемого вещества и объемы анализируемых растворов следует отмеривать с максимальной точностью (бюреткой, пипеткой). Конечные объемы растворов должны быть одинаковыми, поэтому их следует готовить в мерных колбах или градуированных пробирках. Растворы, предназначенные для градуировки фотометрического прибора и анализируемые растворы желательно готовить одновременно.
3. Кюветы, предназначенные для измерения поглощения растворов, должны быть тщательно очищены. Их моют концентрированной HCl, промывают дистиллированной водой и насухо вытирают снаружи. Высушивают кюветы изнутри только при работе с органическими растворителями, несмешивающимися с водой. Во всех других случаях кювету перед заполнением лишь ополаскивают небольшой порцией раствора во избежание его разбавления. Заполняют кювету до такого уровня, чтобы световой поток полностью проходил через слой раствора.
Загрязненные органическими веществами кюветы рекомендуют предварительно очищать органическими растворителями.
4. Кюветы следует устанавливать в кюветное отделение прибора всегда в строго определенное положение во избежание погрешностей, связанных с отражением и рассеянием светового потока. Для установки кювет в кюветное отделение используют специальный кюветодержатель. Кюветодержатель крепится на подвижной каретке. Перемещая каретку, в световой поток постепенно вводят кюветы с раствором сравнения и измеряемыми растворами. Следует избегать вытекания раствора из кюветы на ее внешние стенки, так как во-первых, это сказывается на прозрачности кюветы, а во-вторых, вызывает коррозию кюветодержателя и кюветного отделения.
5. Познакомиться с описанием и порядком измерения на фотометрическом приборе. Включить прибор за 15 мин до начала измерений. Отсчет по измерительной шкале прибора необходимо сделать несколько раз, повторив процедуру настройки шкалы, до получения воспроизводимых результатов. Иногда полезно повторно наполнить кювету и провести измерение вновь. Отсчет по измерительной шкале необходимо производить с точностью, указанной в паспорте прибора (0,001 единицы А в случае спектрофотометров; 0,01 единицы А в случае фотометров).
6. По окончании работы необходимо выключить прибор, вымыть кюветы и использованную мерную посуду, привести в порядок рабочее место.
7. Записи в лабораторном журнале рекомендуется делать в следующем порядке: а) название выполняемой работы; б) формула фотометрируемого соединения; в) краткая методика приготовления фотометрируемых растворов; г) условия проведения измерений; д) результаты измерений в виде таблиц и графиков; е) обработка результатов измерений и оценка значений определяемых величин.
Анализ однакомпонентных систем фотометрическим методом
При выполнении фотометрических определений определяемое вещество в большинстве случаев с помощью подходящей фотометрической реакции переводят в форму, обладающую значительным поглощением в УФ или видимой области спектра.
Условия проведения этой реакции должны обеспечивать полноту образования светопоглощающего соединения и выполнение основного закона светопоглощения в широком диапазоне концентрации. Для получения воспроизводимых и надежных результатов при выполнении фотометрических определений следует также оптимизировать условия измерения светопоглощения образующегося соединения. Оптимизация условий фотометрических измерений предполагает:
— выбор длины волны (спектрального диапазона);
— выбор толщины кюветы;
— нахождение области линейности определяемых концентраций.
Порядок работы. 1. Готовят пять растворов с известным содержанием определяемого вещества согласно одной из приведенных ниже методик.
2. Измеряют на фотометре оптические плотности третьего раствора со всеми светофильтрами, кроме первого, в кювете с l=1 см. Результаты измерений записывают по следующей форме:
Таблица 1 – Выбор светофильтра (с3 = ... мкг/мл, 1=1 см)
Номер светофильтра |
1 |
2 |
3 |
и т. д. |
А |
|
|
|
|
Выбирают светофильтр, для которого оптическая плотность имеет наибольшее значение.
Сравнивают значения max пропускания выбранного светофильтра (приводится в описании фотометра) и max, полосы поглощения фотометрируемого соединения.
Подбирают кювету с таким расчетом, чтобы измеряемые значения оптических плотностей приготовленных растворов с выбранным светофильтром укладывались в оптимальном диапазоне.
3. Измеряют оптические плотности растворов сравнения и анализируемого растворов в выбранной кювете с выбранным светофильтром. Результаты измерений записывают по следующей форме:
Таблица 2 – Данные для построення градуировочного графика ( № светофильтра,..., l=...см)
Номер раствора |
1 |
2 |
3 |
… |
анализируемый |
с, мкг/мл |
|
|
|
|
|
А |
|
|
|
|
|
По данным табл.2 строят градуировочный график в координатах А - с (мкг/мл) и находят массу элемента в анализируемом растворе тх.
4. Рассчитывают чувствительность фотометрического способа определения элемента и коэффициент молярного поглощения фотометрируемого соединения на основании регрессионного анализа градуировочного графика. Процедуру расчета выполняют на микро-ЭВМ или микрокалькуляторе. Результаты расчета коэффициентов линейного градуировочного графика А = ао + а1с представляют в следующем виде:
ao=…; s(ao)=…; ao=s(ao)t(p=0,95,f)=…;
a1=…; s(a1)=…; a1=s(a1)t(p=0,95,f)=…;
Значение коэффициента молярного поглощения фотометрируемого соединения следует записывать, выделяя целую степень десяти, например: ε=(Ν±ΔΝ)· 10".
Практические работы Работа 1
Определение никеля диметилглиоксимом в присутствия окислителей
В щелочной среде (аммиак, щелочь) в присутствии окислителя (бром, иод, пероксид водорода, персульфат аммония) никель образует с диметилглиоксимом (H2D) растворимый в воде красно-коричневый комплекс. Установлено, что в результате реакции происходит окисление никеля, вероятно, до Ni(III). В зависимости от того, проводится ли реакция в среде аммиака или среде щелочи, образуются два различных комплекса, отличающиеся своими спектральными характеристиками. Комплекс, образующийся в щелочной среде, характеризуется интенсивной полосой поглощения с max=470 нм и εmax 1,3104. Соотношение Ni:H2D в комплексе равно 1:3.
Для аналитических целей лучшим окислителем является иод, так как получающееся в его присутствии комплексное соединение более устойчиво во времени. Кроме того, избыток иода не окисляет диметилглиоксим, что позволяет добиться хорошей воспроизводимости результатов фотометрических определений. Определению никеля описанной фотометрической реакцией мешают большинство элементов. Их чаще всего маскируют тартратами или цитратами.
Реагенты
Стандартный раствор никеля (II), 0,01 мг/мл.
Иод, 0,05 Μ раствор.
Диметилглиоксим, 1%-ный раствор в 20%-ном растворе NaOH.
Выполнение определения. В пять мерных колб вместимостью 50,0 мл вводят 20 мл воды, стандартный раствор никеля с содержанием (мг): 0,02; 0,04; 0,06; 0,08 и 0,10 соответственно, 0,5 мл раствора иода, 0,5 мл раствора диметилглиоксима. Содержимое колб разбавляют водой до метки. Через 10 мин растворы фотометрируют относительно воды и строят градуировочный график.
Аликвотную часть анализируемого раствора помещают в мерную колбу вместимостью 50,0 мл, разбавляют водой до 20 мл и далее проводят те же операции и в той же последовательности, что и при приготовлении растворов, используемых для градуировки. Спустя 10 мин после приготовления, раствор фотометрируют относительно воды. Содержание никеля находят по градуировочному графику.
Работа 2 Определение железа(Ш) сульфосалициловои кислотой
Железо(Ш) образует с сульфосалициловой кислотой в зависимости от кислотности раствора ряд окрашенных комплексов. При рН 1,8-2,5 образуется красно-фиолетовый катионный комплекс (I), имеющий полосу поглощения с max=510 нм и max= 1,8103

При увеличении рН до 4-8 раствор приобретает красно-бурую окраску, которую приписывают анионному бис-комплексу(II).
В щелочных средах (9 < рН < 11,5) образуется комплекс желтого цвета с полосой поглощения max=416 нм и max=5,8103. При рН > 12 происходит его разложение с выпадением в осадок гидроксида железа. Ранее предполагалось, что образующийся в щелочных средах комплекс является трисульфосалицилатом Fe(lII). Однако в более поздних исследованиях высказывается другая точка зрения относительно природы этого комплекса. Предполагают, что его образование связано не с присоединением третьей молекулы реагента, а с депротонированием бис-комплекса:
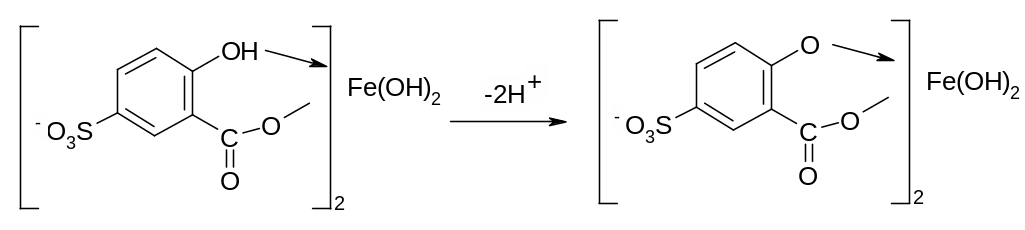
В результате упрочнения связи атома железа с фенольным кислородом происходит сдвиг полосы поглощения бис-комплекса в коротковолновую область спектра.
В практике молекулярного абсорбционного анализа применяются лишь комплексы, образующиеся в кислой и щелочной средах. Моносульфосалицилатный комплекс используют для определения Fe (III) в присутствии Fe (II), магния, марганца, меди, алюминия, редкоземельных элементов. Фториды мешают определению Fе (III).
В щелочной среде вследствие легкой окисляемости Fe (II) в Fe (III) с помощью сульфосалициловои кислоты можно определить сумму Fe (II) и Fе (III). Фторид-ионы не мешают определению железа сульфосалициловои кислотой в щелочной среде.
