
- •Кинематика
- •Модели в механике
- •2.Кинематическое описание движения
- •4.Перемещение. Скорость. Вычисление пройденного пути
- •6. Плоское вращение. Угловая скорость и ускорение. Связь между векторами скорости и угловой скорости.
- •Динамика материальной точки
- •1.Основная задача механики. Законы Ньютона
- •2. Система единиц си. Границы применимости классической механики
- •3. Импульс. Закон сохранения импульса системы материальных точек. Применение закона сохранения импульса к абсолютно неупругому удару. Движение тел с переменной массой.
- •4.Момент импульса. Момент силы. Основное уравнение динамики вращательного движения. Закон сохранения момента импульса.
- •5. Силы в природе. Четыре вида взаимодействия. Силы сухого и вязкого трения
- •6. Упругая сила.Закон Гука. Деформация тела
- •7. Энергия. Работа. Мощность. Кинетическия энергия
- •8. Консервативные и неконсервативные силы. Потенциальная энергия
- •9. Закон сохранения энергии в механике
- •10. Применение з-ов сохранения к абсолютно упругому удару
- •11.Закон всемирного тяготения. Движение в центральном поле. Космические скорости. Законы Кеплера
- •Динамика абсолютно твёрдого тела
- •Вращение абсолютно твёрдого тела вокруг неподвижной оси и его кинетическая энергия
- •3.Момент инерции тела и его физический смысл. Пример вычисления момента инерции твёрдого тела. Теорема Штейнера Согласно определению момент инерции твёрдого тела равен
- •Момент инерции тела относительно нецентральной оси Теорема Штейнера
- •6. Гироскоп. Угловая скорость прецессии
- •Колебания
- •1.Уравнения гармонических колебаний и его основные параметры
- •2..Колебания груза под действием упругой сил. Энергия гармонических колебаний
- •Математический и физич маятники
- •4.Уранение затухающих гармонических колебаний. Декремент затухания, добротность.
- •5.Вынужденные колебания. Резонанс
- •6.Сложение гармонических колебаний одинаковой частоты и направления. Векторная диаграмма
- •7. Сложение гармонических колебаний различной частоты. Биения
- •8. Сложение гармонических колебаний одинаковой частоты и взаимно перпендикулярного направления . Фигуры Лиссажу.
- •1.Волновые процессы. Продольные и поперечные волны
- •2.Уравнение плоской гармонической волны и её основный параметры. Фазовая скорость. Волновой пакет. Групповая скорость
- •3.Волновое уравнение
- •4.Фазовая скорость волны в твёрдых телах
- •5. Скорость звука в газах
- •6. Энергия упругой волны. Вектор Умова. Громкость звука
- •7. Стоячие волны. Колебания струны.
- •8. Эффект Доплера для акустических волн
- •Мкт газов
- •1.Статистический и термодинамический методы исследования. Опытные законы идеального газа. Уравнение Клайперона-менделеева
- •2,Основное уравнение молекулярно – кинетической теории газов.
- •Молекулярно-кинетический смысл температуры
- •3,Число степеней свободы. Закон равномерного распределения энергии по степеням свободы молекул газа. Внутренняя энергия идеального газа
- •4.Распределение Максвелла. Средняя, среднеквадратичная и наиболее вероятная скорости газовых молекул.Максвелловское распределение молекул по их скоростям и энергиям
- •5 Барометрическая формула. Распределение Больцмана
- •6.Среднее число столкновений и средняя длина свободного пробега молекул
- •7. Явление переноса в термодинамическинеравноверстных системах. Тепло-проводимость. Диффузия. Вязкость
- •Термодинамика
- •1.Внутренняя энергия системы. Работа и теплота
- •2.Первое начало термодинамики. Графическое изображение термодинамических процессов и работы
- •3.Теплоёмкость вещества. Уравнение Майера
- •4.Адиабатный и политропный процессы идеального газа
- •5.Классическая теория теплоёмкостей идеального газа и её трудности. Квантомеханическое объяснение
- •6,Круговой процесс(цикл) Обратимые и необратимые процессы
- •7.Энтропия , её статистическое толкование и связь с термодинамической вероятностью
- •8,Второе начало термодинамики
- •9. Тепловые двигатели и холодильные машины. Цикл карно. Теорема Карно
- •Реальные газы, жидкости и твёрдые тела
- •1.Силы и потенциальная энергия межмолекулярного взаимодействия
- •2. Уравнение Ван-дер-Ваальса
- •3.Изотермы Ван-дер-Ваальса и их анализ. Критические состояния
- •4. Внутренняя энергия реального газа
- •5.Фазовые переходы 1и 11 рода. Диаграмма состояния. Тройная точка. Уравнение Клайперона-Клаузиуса
- •6.Свойчтва жидкостей. Поверхностное напряжение
- •7. Твёрдые тела. Типы кристаллических твёрдых тел
3.Теплоёмкость вещества. Уравнение Майера
Уд-я
теплоемкость вещества вел-а,
равная кол-у теплоты, необходдля
нагревания 1 кг в-а на 1 К:![]() Единица
удельной тепл-ти(Дж/(кг•К))Молярная
тепло-сть— вел-а,
равная кол-ву теплоты, необход для
нагревания 1 моля в-ва на 1 К:
Единица
удельной тепл-ти(Дж/(кг•К))Молярная
тепло-сть— вел-а,
равная кол-ву теплоты, необход для
нагревания 1 моля в-ва на 1 К:![]() где
v
= m/M
— кол-во в-ва, выражающее число молей.Един
мол-ой тепл-ти — джоуль на моль-кельвин
(Дж/(моль•К)).Удельная тепл-тьс
связана
с молярной СmсоотношениемСт
= сМ, (53.2)где
М
— молярная
масса вещества.Различаюттепл-ти при
постоянном объеме и постоянном
давлении, если в процессе нагревания
вещества его объем или давление
поддерживается постоянным.Запишем
выражение первого начала термодинамики
(51.2) для 1 моля газа с учетом формул (52.1)
и (53.1):CmdT
= dUm
+ pdVm.
(53.3)Если
газ нагревается при постоянном объеме,
то работа внешних сил равна нулю (см.
(52.1)) и сообщаемая газу извне теплота
идет только на увеличение его внутренней
энергии:
где
v
= m/M
— кол-во в-ва, выражающее число молей.Един
мол-ой тепл-ти — джоуль на моль-кельвин
(Дж/(моль•К)).Удельная тепл-тьс
связана
с молярной СmсоотношениемСт
= сМ, (53.2)где
М
— молярная
масса вещества.Различаюттепл-ти при
постоянном объеме и постоянном
давлении, если в процессе нагревания
вещества его объем или давление
поддерживается постоянным.Запишем
выражение первого начала термодинамики
(51.2) для 1 моля газа с учетом формул (52.1)
и (53.1):CmdT
= dUm
+ pdVm.
(53.3)Если
газ нагревается при постоянном объеме,
то работа внешних сил равна нулю (см.
(52.1)) и сообщаемая газу извне теплота
идет только на увеличение его внутренней
энергии:![]() т.
е. молярная теплоемкость газа при
постоянном объеме Сvравна
изменению внутренней энергии 1 моля
газа при повышении его температуры
на 1 К. Согласно формуле (50.1),
т.
е. молярная теплоемкость газа при
постоянном объеме Сvравна
изменению внутренней энергии 1 моля
газа при повышении его температуры
на 1 К. Согласно формуле (50.1),![]() тогдаCv
= iR/2.
(53.5)Если
газ нагревается при постоянном давлении,
то выражение (53.3) можно записать в
виде
тогдаCv
= iR/2.
(53.5)Если
газ нагревается при постоянном давлении,
то выражение (53.3) можно записать в
виде![]() Учит,
что dUm/dT
не зависит от вида процесса (внутр-я
энергия ид-ого газа не зависит ни от р,
ни
от V,
а определ
лишь Т)
и
всегда равна Сv(см.
(53.4)); продиф-авур-е Клап- — Мен-еваpVm=RT(42.4)
по T(p=const),
получимCp
= Cv
+ R.
(53.6)Выражение
(53.6) называется ур-ем
Майера; оно
показ, что Срвсегда
>Сvна
величину молярной газовой постоянной.
Это объясняется тем, что при нагревании
газа при постоянном давл требуется еще
дополнительное количество теплоты на
совершение работы расширя газа, так как
постоянство давления обеспечивается
увеличением объема газа.Использовав
(53.5), выражение (53.6) можно записать в
виде
Учит,
что dUm/dT
не зависит от вида процесса (внутр-я
энергия ид-ого газа не зависит ни от р,
ни
от V,
а определ
лишь Т)
и
всегда равна Сv(см.
(53.4)); продиф-авур-е Клап- — Мен-еваpVm=RT(42.4)
по T(p=const),
получимCp
= Cv
+ R.
(53.6)Выражение
(53.6) называется ур-ем
Майера; оно
показ, что Срвсегда
>Сvна
величину молярной газовой постоянной.
Это объясняется тем, что при нагревании
газа при постоянном давл требуется еще
дополнительное количество теплоты на
совершение работы расширя газа, так как
постоянство давления обеспечивается
увеличением объема газа.Использовав
(53.5), выражение (53.6) можно записать в
виде![]() При
рассм-и термодинам-х процессов важно
знать хар-ое для каждого газа отношение
Ср
к Cv=Cp/Cv=(i+2)/i.
(53.8)
При
рассм-и термодинам-х процессов важно
знать хар-ое для каждого газа отношение
Ср
к Cv=Cp/Cv=(i+2)/i.
(53.8)
4.Адиабатный и политропный процессы идеального газа
. Термодинамика адиабатического процесса: dQ=0
Адиабатический
процесс
- это
процесс, протекающий без теплообмена
с окружающей средой.ПосколькуdQ
= 0,
то первое начало термодинамики примет
вид: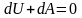 - первое
начало термодинамики при адиабатическом
процессе
- первое
начало термодинамики при адиабатическом
процессе
Такой
вид первого начала термодинамики
позволяет легко вычислить работу,
совершаемую газом: или
для конечного адиабатического процесса:
или
для конечного адиабатического процесса:
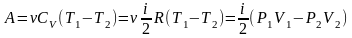 -работа,
совершаемая газом при адиабатическом
процессе.
-работа,
совершаемая газом при адиабатическом
процессе. -
уравнение адиабатического процесса в
переменных(T,V)
-
уравнение адиабатического процесса в
переменных(T,V)
 -
уравнения
адиабаты.Политропный
процесс
-
уравнения
адиабаты.Политропный
процесс
Политропный процесс — термодинамический процесс, во время которого удельная теплоёмкость c газа остаётся неизменной. Предельными частными явлениями политропного процесса являются изотермический процесс и адиабатный процесс. В случае идеального газа изобарный процесс и изохорный процесс также являются политропическими.Для идеального газа уравнение политропы может быть записано в виде:
pVn = const
где величина называется показателем политропы.
5.Классическая теория теплоёмкостей идеального газа и её трудности. Квантомеханическое объяснение
 Обьект
- ИГ Теплоемкостью тела С называется
отношение бесконечно маюго количества
тепла бQ,
полученного телом, к соответствующему
приращению dT
его температуры:
Обьект
- ИГ Теплоемкостью тела С называется
отношение бесконечно маюго количества
тепла бQ,
полученного телом, к соответствующему
приращению dT
его температуры:![]() Когда масса тела равна единице,
теплоемкость называют удельной — ее
мы будем обозначать малой буквой с.
Более удобна молярная теплоемкость.
Так называют теплоемкость одного моля
вещества. Эту величину мы будем обозначать
большой буквой С.Особое значение имеют
теплоемкости при постоянном объеме и
постоянном давлении, обозначаемые
символами Сv
и Ср.
Когда масса тела равна единице,
теплоемкость называют удельной — ее
мы будем обозначать малой буквой с.
Более удобна молярная теплоемкость.
Так называют теплоемкость одного моля
вещества. Эту величину мы будем обозначать
большой буквой С.Особое значение имеют
теплоемкости при постоянном объеме и
постоянном давлении, обозначаемые
символами Сv
и Ср.
![]()
![]() КЛАССИЧЕСКАЯ
ТЕОРИЯ ТЕПЛОЕМКОСТИ Эта теория
основывается на предполо- предположении
о равномерном распределении энергии
по степеням свободы движения молекулы.
Молекула идеал. однотомного газа,
рассматриваемая как мат. точка, может
иметь только энергию поступательного
движения. Энергией вращательного
движения такая молекула не обладает
вследствие того, что при соударениях
молекул идеального одноатомного газа
энергия вращательного движения не
передается. Теорема Больцмана — Максвелла
утверждает далее, что такое же количество
внергии приходится на одну степень
свободы в любом газе, независимо от
числа степеней свободы, которыми обладает
молекула этого газа. Поэтому задача о
вычислении энергии газовой молекулы,
а следовательно, и об определении его
теплоемкости, сводится к определе-
определению числа степеней свободы
газовой молекулы. Число степеней свободы
в сложных молекулах может быть значительно
больше шести, так как имеются многочисленные
степени свободы колебательного движения
атомов. Каждое колебательное движение
в молекулы дает две степени свободы:
одна из них соответствует кинетической
энергиимолекулы, другая — потенциальной.
Трудности классической теории: 1. Даже
при "Комнатных" температурах
теплоюмкости разных газов с одиннаковыми
количеством атомов отличаютьсядркг от
друга, и не кратны R.
2. Согласно Кл. теории С газов не должно
зависить от T,
на самом деле С сильно понижаетися с
понижением Т.
КЛАССИЧЕСКАЯ
ТЕОРИЯ ТЕПЛОЕМКОСТИ Эта теория
основывается на предполо- предположении
о равномерном распределении энергии
по степеням свободы движения молекулы.
Молекула идеал. однотомного газа,
рассматриваемая как мат. точка, может
иметь только энергию поступательного
движения. Энергией вращательного
движения такая молекула не обладает
вследствие того, что при соударениях
молекул идеального одноатомного газа
энергия вращательного движения не
передается. Теорема Больцмана — Максвелла
утверждает далее, что такое же количество
внергии приходится на одну степень
свободы в любом газе, независимо от
числа степеней свободы, которыми обладает
молекула этого газа. Поэтому задача о
вычислении энергии газовой молекулы,
а следовательно, и об определении его
теплоемкости, сводится к определе-
определению числа степеней свободы
газовой молекулы. Число степеней свободы
в сложных молекулах может быть значительно
больше шести, так как имеются многочисленные
степени свободы колебательного движения
атомов. Каждое колебательное движение
в молекулы дает две степени свободы:
одна из них соответствует кинетической
энергиимолекулы, другая — потенциальной.
Трудности классической теории: 1. Даже
при "Комнатных" температурах
теплоюмкости разных газов с одиннаковыми
количеством атомов отличаютьсядркг от
друга, и не кратны R.
2. Согласно Кл. теории С газов не должно
зависить от T,
на самом деле С сильно понижаетися с
понижением Т.
Оказалось что энергия врашательного и колебательного движения молекул являеться квантовой, тоесть может изменятися порциями или скочками, причем расстояние между уровнями примерно на порядок выше чем энергия врашения. График имеет восходяший участок это объясняеться тем что при повышении температуры невсе молекулы одновременно переходят в другую стадию движения.Квантовая теория теплоёмкостей Эйнштейна − была создана Эйнштейном в 1907 году, при попытке объяснить экспериментально наблюдаемую зависимость теплоёмкости от температуры.
При
разработке теории Эйнштейн опирался
на следующие предположения:Атомы в
кристаллической решетке ведут себя как
гармонические осцилляторы, не
взаимодействующие друг с другом.Частота
колебаний всех осцилляторов одинакова.Число
осцилляторов в 1 моле вещества равно
3Na,
где Na
- число Авогадро.Энергия их квантована:![]()
![]() Число
осцилляторов с различной энергией
определяется распределением Больцмана:
Число
осцилляторов с различной энергией
определяется распределением Больцмана:
![]() Внутренняя
энергия 1 моля вещества:
Внутренняя
энергия 1 моля вещества:![]() .
. находится
из соотношения для среднего значения:
находится
из соотношения для среднего значения:![]() и
составляет:
и
составляет:![]() ,отсюда:.
,отсюда:.![]() Определяя
теплоёмкость как производную внутренней
энергии по температуре, получаем
окончательную формулу для теплоёмкости:
Определяя
теплоёмкость как производную внутренней
энергии по температуре, получаем
окончательную формулу для теплоёмкости:
.![]() Согласно
модели, предложенной Эйнштейном, при
абсолютном нуле температуры теплоёмкость
стремится к нулю, при больших температурах,
напротив, выполняется закон
Дюлонга-Пти.Недостатки теории:
Согласно
модели, предложенной Эйнштейном, при
абсолютном нуле температуры теплоёмкость
стремится к нулю, при больших температурах,
напротив, выполняется закон
Дюлонга-Пти.Недостатки теории:
Расхождение теорий Эйнштейна и Дебая,Однако теория Эйнштейна недостаточно хорошо согласуется с результатами экспериментов в силу неточности некоторых предположений Эйнштейна, в частности, предположения о равенстве частот колебаний всех осцилляторов. Более точная теория была создана Дебаем в 1912 году.
