
- •Курс: охрана окружающей среды в теплотехнологии: выбросы теплотехнических установок
- •Модуль 2
- •Оглавление
- •Дидактический план
- •Литература Государственные стандарты Российской Федерации и руководящие документы
- •Основная
- •Дополнительная
- •1. Образование и методы снижения выбросов оксидов азота
- •1.1. Образование оксидов азота при горении органических топлив
- •1.2. Режимные мероприятия по снижению выбросов оксидов азота
- •1.3. Технологические методы снижения выбросов оксидов азота при факельном сжигании органического топлива
- •1.3.1. Влияние конструкции горелки на эмиссию оксидов азота
- •1.3.2. Различные схемы ступенчатого сжигания
- •1.3.3. Рециркуляция дымовых газов
- •1.3.4. Предварительный подогрев угольной пыли
- •1.4. Очистка дымовых газов от оксидов азота
- •1.4.1. Селективное каталитическое восстановление оксидов азота
- •1 Дымовой газ; 2 датчики расхода; 3 датчики nOx; 4 блок управления технологическим процессом; 5 емкость nh3; 6 воздух; 7 реактор denox; 8 чистый газ
- •1.4.2. Селективное некаталитическое восстановление оксидов азота
- •1.4.3. Гибридная схема очистки дымовых газов от оксидов азота
- •1.5. Методы расчетного определения мощности и валовых выбросов оксидов азота котлами тэс
- •2. Образование и методы снижения выбросов диоксида серы, ванадия и бенз(а)пирена
- •2.1. Сероочистка дымовых газов тэс
- •2.1.1. Концепция сероочистки
- •2.2. Основные технологии сероочистки дымовых газов
- •Краткая характеристика технологий сероочистки Сухие технологии
- •Мокро-сухие технологии
- •Мокрые технологии
- •Конверсия so2 в so3
- •2.3. Методы снижения выбросов соединений ванадия при сжигании жидкого топлива
- •2.4. Образование и методы снижения выбросов бенз(а)пирена при сжигании топлив
- •2.4.1. Физико-химические свойства бенз(а)пирена и условия его образования
- •2.4.2. Экологическая характеристика бенз(а)пирена
- •2.4.3. Условия нормирования выбросов бенз(а)пирена с уходящими газами котельных установок
- •2.4.4. Влияние конструктивных особенностей и режимных параметров котлов на образование бенз(а)пирена при сжигании различных топлив
- •Газомазутные котлы
- •Пылеугольные котлы
- •Котлы малой мощности
- •2.4.5. Рекомендации по снижению выбросов бенз(а)пирена в атмосферу с уходящими газами котельных установок
- •3. Охрана водного бассейна от сбросов энергопредприятий
- •3.1 Охрана водного бассейна от сбросов тэс
- •Технология водоиспользования на тэс
- •Охлаждение конденсаторов турбин
- •Системы гидрозолоудаления
- •Сточные воды, загрязненные нефтепродуктами
- •Обмывочные воды регенеративных воздухоподогревателей (рвп) и поверхностей нагрева котлов при сжигании сернистых мазутов
- •Химические промывки и консервация оборудования
- •Подготовка добавочной воды котлов и подпиточной воды теплосети
- •Поверхностные ливневые и талые сточные виды с территории тэс
- •Грунтовые воды систем водопонижения
- •3.2. Нормирование сбросов загрязняющих веществ со сточными водами тэс
- •Экономический механизм природопользования
- •3.4. Основные направления сокращения сброса и утилизации сточных вод Воды систем охлаждения
- •Сточные воды, загрязненные нефтепродуктами
- •Обмывочные воды рвп и поверхностей нагрева котлов
- •Сточные воды химических промывок и консервации оборудования
- •Поверхностные, ливневые и талые сточные воды с территории тэс
- •Воды систем гидрозолоудаления
- •Грунтовые воды
- •Сточные воды водоподготовительных установок
- •Методы очистки сточных вод
- •3.5.1. Механическая очистка сточных вод
- •3.5.2. Химические методы очистки сточных вод
- •3.5.3. Физико-химические методы очистки сточных вод
- •1 Чан с исходным питанием; 2 насос для подачи водовоздушной смеси; 3 насос для подачи реагентов; 4 камера; 5 желоб для шламов; 6 труба для отвода очищенной жидкости
- •1 Корпус; 2 блок аэрации; 3 импеллеры; 4 сетка; 5 осветлитель пластинчатый; 6 шибер, 7 пенный желоб; 8 рама с подставкой
- •3.5.4. Основы биологической очистки сточных вод
- •3.5.5. Устройства для биологической очистки сточных вод
- •3.5.6. Доочистка сточных вод на активированных углях
- •3.5.7. Очистка поверхностных сточных вод предприятий энергетики и транспорта
- •1 Резервуар грязной воды; 2 и 6 насосы; 3 флотационная машина; 4 емкость для сбора пенопродукта; 5 резервуар чистой воды; 7 фильтры
- •Задания для самостоятельной работы
- •1. Перечислите технологические методы снижения выбросов оксидов азота:
- •2. Перечислите технологии сероочистки дымовых газов с использованием кальцита и извести:
- •3. Перечислите мероприятия режимного и технологического плана по снижению выбросов бенз(а)пирена:
- •5. Перечислите основные методы очистки сточных вод:
- •Глоссарий
- •Охрана окружающей среды в теплотехнологии: выбросы теплотехнических установок модуль 2
Основная
Техника и технология защиты воздушной среды / В.В. Юшин, В.Л. Лапин, В.М. Попов, П.П. Кукин, Н.И. Сердюк, Д.А. Кривошеин, Н.Л. Пономарев, Ю.П. Ковалев. – М.: Высш. шк., 2005. – 392 с.
Экология энергетики / Под общей редакцией В.Я. Путилова. М.: Издательство МЭИ, 2003. – 716 с. *
Калыгин В.Г. Промышленная экология / В.Г. Калыгин. – М., Издательский центр «Академия», 2004. – 432 с.
Дополнительная
Промышленная теплоэнергетика и теплотехника: Справочник / Под общ. ред. Клименко А.В. и Зорина В.М. М.: Издательство МЭИ, 2004. – 632 с. (Кн. 4).*
Повышение экологической безопасности тепловых электростанций / А.И. Абрамов, Д.П. Елизаров, А.Н. Ремезов, А.С. Седлов, Л.С. Стерман, В.В. Шищенко; Под ред. А.С. Седлова. – М.: Издательствно МЭИ, 2001. – 378 с. *
ТЕМАТИЧЕСКИЙ ОБЗОР
1. Образование и методы снижения выбросов оксидов азота
1.1. Образование оксидов азота при горении органических топлив
Источниками образования оксидов азота при сжигании органического топлива являются азот воздуха и азотсодержащие компоненты топлива. Из азота воздуха оксиды азота образуются при высоких температурах (Т 1800 К) в некотором температурном интервале. Эти оксиды азота называются «термическими».
Азот - химический элемент второго периода VA группы периодической системы, атомный номер 7, атомная масса 14,0067. В свободном виде газ без цвета, запаха и вкуса, плохо растворим в воде. Состоит из двухатомных молекул N2, обладающих высокой прочностью. Относится к неметаллам.
Кроме того, из азота воздуха во фронте факела при сравнительно низких температурах образуется небольшое количество «быстрых» оксидов азота.
Образование топливных NОx происходит на начальном участке факела, при горении летучих, выделившихся из частиц угля или мазутных капель. Одновременно с образованием оксидов азота происходит восстановление NО до безвредного молекулярного азота N2, причем соотношение между окислительными и восстановительными реакциями определяется наличием свободного кислорода или других окислителей.
Применительно к топочным устройствам энергетических (а тем более промышленных и отопительных котлов) можно утверждать, что количество образующихся оксидов азота определяется кинетикой процессов, так как время пребывания в высокотемпературной зоне значительно меньше времени, необходимого для достижения равновесных концентраций.
Оксиды азота, поступившие в атмосферу из котлов ТЭС, приносят больший вред окружающей среде независимо от механизма их образования. Однако для сокращения этих выбросов весьма важно знать, как образовались оксиды азота, поскольку количество термических, быстрых и топливных NОx зависит от основных параметров топочного процесса.
Среди различных форм оксидов
азота: N2O,
NO,
N2O3,
NO2,
N2O4,
N2O5
практическое значение в экологическом
аспекте имеют оксид и диоксид (NO
и NO2),
сумму которых (обычно в пересчете на
NO2)
принято обозначать как NOx.
Оксид азота
прозрачный, бесцветный газ,
превращающийся в жидкость при температуре
151,7 °С и атмосферном давлении. Плотность
NO
(при
t
= 20 °С) равна 1,34 кг/м3.
Это химически малоактивный, плохо
растворимый в воде газ. Образующиеся
при сжигании топлив и содержащиеся в
дымовых газах оксиды азота на 97
99 % состоят из NO.
Монооксид азота относительно менее
токсичен: установленные в России величины
максимально разовой и среднесуточной
предельно допустимой концентрации
для NO
соответственно равны:
![]() = 0,4 мг/м3;
= 0,4 мг/м3;
![]() =
0,06 мг/м3.
Однако в шлейфе дымовых газов NO
доокисляются до NO2.
=
0,06 мг/м3.
Однако в шлейфе дымовых газов NO
доокисляются до NO2.
В отличие от монооксида
азота NО2
более активный в химическом отношении
газ красно-бурого цвета с удушливым и
резким, раздражающим запахом. Диоксид
азота хорошо растворим в воде, легко
сжижается при атмосферном давлении и
температуре 21,15 °С в красно-бурую
жидкость, которая при t
=
10,2 °С твердеет, образуя бесцветные
кристаллы. Плотность NО2
(при 20 °С) равна 2,05 кг/м3.
Диоксид азота оказывает отрицательное
влияние на здоровье людей. Проявляется
это прежде всего в поражении дыхательной
системы, легких. Крайне опасным для
жизни может оказаться даже кратковременное
вдыхание воздуха с концентрацией
диоксида азота
![]() =
200
500 мг/м3.
Особенно подвержены воздействию
диоксида азота дети.
=
200
500 мг/м3.
Особенно подвержены воздействию
диоксида азота дети.
Большую опасность для живых организмов представляет образование еще более вредных, канцерогенных веществ в реакциях с участием оксидов азота. Диоксид азота, обладая высокой поглощающей способностью в ультрафиолетовой области спектра, при наличии в воздухе других загрязняющих ингредиентов, например углеводородов, вступает с ними в реакции с образованием фотохимических туманов (смогов), содержащих ядовитые вещества.
Заканчивая перечисление экологических воздействий, связанных с выбросами оксидов азота в атмосферу, необходимо упомянуть о кислотных дождях, приносящих большой ущерб водным и лесным экосистемам, сельскохозяйственным угодьям, а также о парниковом эффекте и озоновом слое атмосферы Земли, в разрушении которого, по мнению ряда ученых, участвует гемиоксид азота N2O.
Основное количество оксидов азота поступает в атмосферу Земли в результате природных процессов. Количество оксидов азота антропогенного происхождения значительно меньше, однако антропогенные выбросы представляют наибольшую опасность, так как сосредоточены в центрах цивилизации. Именно по причине антропогенных выбросов в десятках городов России превышены допустимые концентрации вредных веществ, в том числе оксидов азота.
Для разработки путей борьбы с образованием оксидов азота важно знать, как они образуются. В настоящее время хорошо изучены три принципиально разных источника оксидов азота:
1) образование термических NO из молекулярного азота воздуха при температуре выше 1300 °С (механизм Зельдовича);
2) образование NО из азота, содержащегося в топливе (топливные NО);
3) образование NО путем реакции молекулярного азота воздуха с углеводородными радикалами («быстрые» NО).
Зависимость образования оксидов азота от температуры представлена на рис. 1.
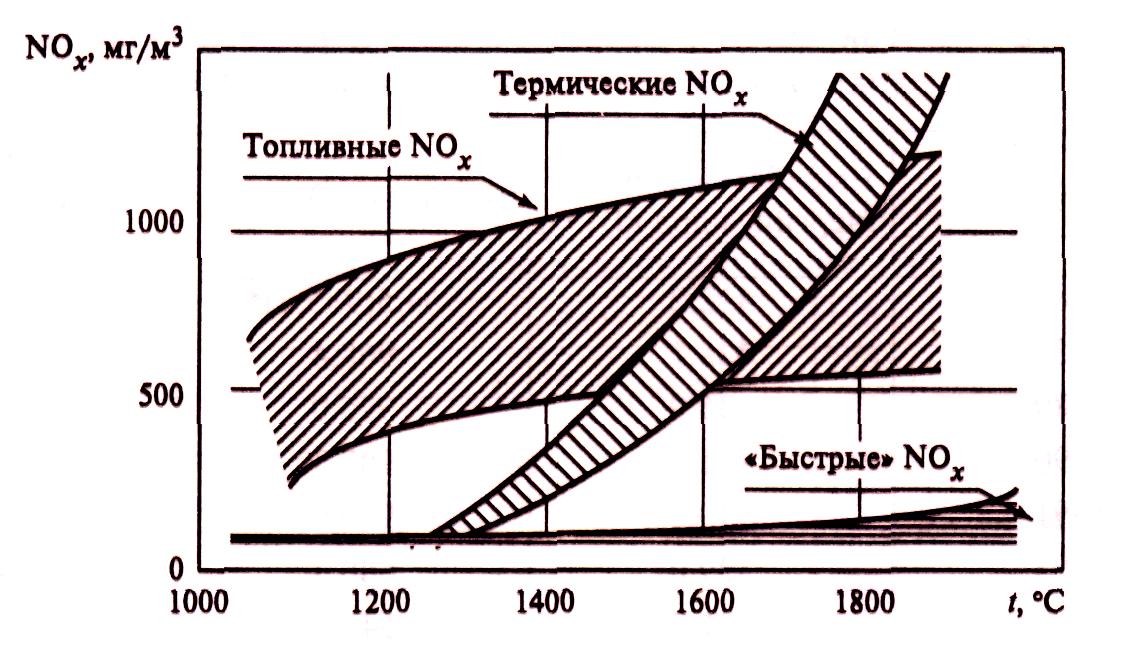
Рис. 1. Зависимость образования оксидов азота от температуры при сжигании
органического топлива
Термические оксиды азота возникают при высоких температурах и достаточном времени пребывания продуктов сгорания в зоне горения из молекулярного азота воздуха, подаваемого в топку котла.
Итоговую реакцию можно записать в виде:
O2 + N2 2NO.
Экспериментальные исследования показали, что скорость образования NО намного меньше скорости горения и что основная часть NО образуется после завершения горения, когда повышение температуры приводит к диссоциации молекулярного кислорода. Скорость обратимых реакций образования и разложения NО в основном зависит от температуры в зоне горения и мгновенных концентраций избыточного кислорода, азота и оксида азота.
Из-за высокой энергии активации основное количество термических оксидов азота образуется в узком диапазоне температур, близком к максимальной температуре в зоне активного горения.
Скорость образования термических NО увеличивается с ростом температуры, она прямо пропорциональна концентрации азота и времени пребывания продуктов сгорания в зоне генерации оксидов азота, а также корню квадратному из концентрации кислорода. Поэтому первичные (ре-жимно-технологические) мероприятия для снижения образования термических NOх основаны на воздействии на один или несколько факторов в зоне максимальной генерации NOх и на создании специальных условий в факеле горения, приводящих к восстановлению образовавшихся оксидов азота до молекулярного азота, как это, например, делается при ступенчатом сжигании топлива.
Образование топливных оксидов азота осуществляется в два этапа: сначала происходит газификация капель мазута или угольных частиц с выделением азотсодержащих соединений (радикалов R) типа CN, CHN, NH, NH2, а затем частичное окисление этих соединений по реакции:
RN + О2 NO + RО.
Топливные оксиды азота образуются параллельно с горением топлива в основной зоне горения за промежуток времени меньший, чем время горения топлива. Из-за малой энергии активации процесс образования NО из азота топлива происходит уже при относительно низких температурах (t 1000 °С). Зависимость выхода топливных оксидов азота от содержания молекулярного кислорода в зоне горения близка к квадратичной. Естественно, важным фактором здесь является содержание азота в топливе.
При сжигании мазута в энергетических котлах доля топливной составляющей оксидов азота относительно невелика, а при сжигании угольной пыли в топках с твердым шлакоудалением доля топливных оксидов азота, как правило, превышает 90 %.
«Быстрые» NO образуются в зоне фронта пламени углеводородных топлив в результате аномально быстрых реакций молекулярного азота с углеводородами, содержащимися в топливе:
N2 + СН HCN + N,
N + ОН NO + Н.
Эти реакции активно протекают уже при температуре около 1300 °С, когда образование термических NО еще не происходит. Концентрация «быстрых» NО растет при увеличении избытка воздуха и температуры и при сжигании природного газа может составить 70 90 мг/м3. С этим приходится считаться при разработке мероприятий по подавлению образования NОх в целях достижения современных норм по выбросу NOх в атмосферу.
