
- •Курс: охрана окружающей среды в теплотехнологии: выбросы теплотехнических установок
- •Модуль 2
- •Оглавление
- •Дидактический план
- •Литература Государственные стандарты Российской Федерации и руководящие документы
- •Основная
- •Дополнительная
- •1. Образование и методы снижения выбросов оксидов азота
- •1.1. Образование оксидов азота при горении органических топлив
- •1.2. Режимные мероприятия по снижению выбросов оксидов азота
- •1.3. Технологические методы снижения выбросов оксидов азота при факельном сжигании органического топлива
- •1.3.1. Влияние конструкции горелки на эмиссию оксидов азота
- •1.3.2. Различные схемы ступенчатого сжигания
- •1.3.3. Рециркуляция дымовых газов
- •1.3.4. Предварительный подогрев угольной пыли
- •1.4. Очистка дымовых газов от оксидов азота
- •1.4.1. Селективное каталитическое восстановление оксидов азота
- •1 Дымовой газ; 2 датчики расхода; 3 датчики nOx; 4 блок управления технологическим процессом; 5 емкость nh3; 6 воздух; 7 реактор denox; 8 чистый газ
- •1.4.2. Селективное некаталитическое восстановление оксидов азота
- •1.4.3. Гибридная схема очистки дымовых газов от оксидов азота
- •1.5. Методы расчетного определения мощности и валовых выбросов оксидов азота котлами тэс
- •2. Образование и методы снижения выбросов диоксида серы, ванадия и бенз(а)пирена
- •2.1. Сероочистка дымовых газов тэс
- •2.1.1. Концепция сероочистки
- •2.2. Основные технологии сероочистки дымовых газов
- •Краткая характеристика технологий сероочистки Сухие технологии
- •Мокро-сухие технологии
- •Мокрые технологии
- •Конверсия so2 в so3
- •2.3. Методы снижения выбросов соединений ванадия при сжигании жидкого топлива
- •2.4. Образование и методы снижения выбросов бенз(а)пирена при сжигании топлив
- •2.4.1. Физико-химические свойства бенз(а)пирена и условия его образования
- •2.4.2. Экологическая характеристика бенз(а)пирена
- •2.4.3. Условия нормирования выбросов бенз(а)пирена с уходящими газами котельных установок
- •2.4.4. Влияние конструктивных особенностей и режимных параметров котлов на образование бенз(а)пирена при сжигании различных топлив
- •Газомазутные котлы
- •Пылеугольные котлы
- •Котлы малой мощности
- •2.4.5. Рекомендации по снижению выбросов бенз(а)пирена в атмосферу с уходящими газами котельных установок
- •3. Охрана водного бассейна от сбросов энергопредприятий
- •3.1 Охрана водного бассейна от сбросов тэс
- •Технология водоиспользования на тэс
- •Охлаждение конденсаторов турбин
- •Системы гидрозолоудаления
- •Сточные воды, загрязненные нефтепродуктами
- •Обмывочные воды регенеративных воздухоподогревателей (рвп) и поверхностей нагрева котлов при сжигании сернистых мазутов
- •Химические промывки и консервация оборудования
- •Подготовка добавочной воды котлов и подпиточной воды теплосети
- •Поверхностные ливневые и талые сточные виды с территории тэс
- •Грунтовые воды систем водопонижения
- •3.2. Нормирование сбросов загрязняющих веществ со сточными водами тэс
- •Экономический механизм природопользования
- •3.4. Основные направления сокращения сброса и утилизации сточных вод Воды систем охлаждения
- •Сточные воды, загрязненные нефтепродуктами
- •Обмывочные воды рвп и поверхностей нагрева котлов
- •Сточные воды химических промывок и консервации оборудования
- •Поверхностные, ливневые и талые сточные воды с территории тэс
- •Воды систем гидрозолоудаления
- •Грунтовые воды
- •Сточные воды водоподготовительных установок
- •Методы очистки сточных вод
- •3.5.1. Механическая очистка сточных вод
- •3.5.2. Химические методы очистки сточных вод
- •3.5.3. Физико-химические методы очистки сточных вод
- •1 Чан с исходным питанием; 2 насос для подачи водовоздушной смеси; 3 насос для подачи реагентов; 4 камера; 5 желоб для шламов; 6 труба для отвода очищенной жидкости
- •1 Корпус; 2 блок аэрации; 3 импеллеры; 4 сетка; 5 осветлитель пластинчатый; 6 шибер, 7 пенный желоб; 8 рама с подставкой
- •3.5.4. Основы биологической очистки сточных вод
- •3.5.5. Устройства для биологической очистки сточных вод
- •3.5.6. Доочистка сточных вод на активированных углях
- •3.5.7. Очистка поверхностных сточных вод предприятий энергетики и транспорта
- •1 Резервуар грязной воды; 2 и 6 насосы; 3 флотационная машина; 4 емкость для сбора пенопродукта; 5 резервуар чистой воды; 7 фильтры
- •Задания для самостоятельной работы
- •1. Перечислите технологические методы снижения выбросов оксидов азота:
- •2. Перечислите технологии сероочистки дымовых газов с использованием кальцита и извести:
- •3. Перечислите мероприятия режимного и технологического плана по снижению выбросов бенз(а)пирена:
- •5. Перечислите основные методы очистки сточных вод:
- •Глоссарий
- •Охрана окружающей среды в теплотехнологии: выбросы теплотехнических установок модуль 2
2. Образование и методы снижения выбросов диоксида серы, ванадия и бенз(а)пирена
2.1. Сероочистка дымовых газов тэс
2.1.1. Концепция сероочистки
Диоксид серы SO2 представляет собой бесцветный газ с резким удушающим запахом и плотностью 2,93 г/нм3, SO2 растворяется воде в соответствии с законом Генри.
Закон Генри закон, по которому при постоянной температуре растворимость газа в данной жидкости прямо пропорциональна давлению этого газа над раствором. Закон пригоден лишь для идеальных растворов и невысоких давлений.
При изменении давления растворимость SO2 изменяется прямо пропорционально абсолютному давлению. При растворении диоксид серы частично взаимодействует с водой, образуя слабую сернистую кислоту, которая диссоциирует на ионы водорода и сульфита:
SO2
+ H2O
H2SO3
2H+
+
![]() .
.
Сернистая кислота H2SO3, слабая двухосновная кислота. В свободном виде не выделена, существует в водных растворах. Соли сернистой кислоты сульфиты.
Ион сульфита взаимодействует со щелочными компонентами воды. Кроме температуры на растворимость SO2 влияет рН поглотительной среды: при значениях рН 3,5 диоксид серы в воде практически не растворяется.
При соприкосновении с SO2 вода быстро насыщается этим веществом; если вода выходит из контакта с SO2, то последний начинает активно выделяться из воды в воздух рабочих помещений или атмосферный воздух. Такое явление происходит в каналах системы гидрозолоудаления (ГЗУ) после выхода пульпы из гидрозатворов скрубберов.
Гидрозолоудаление система удаления золы и шлака из топочной камеры и газоходов котельного агрегата водой. Одновременно осуществляется транспортирование золы и шлака на золовые поля или в отвалы.
Практическое отсутствие воздействия SO2 собственно на процесс производства энергии «компенсируется» активным воздействием этого вещества на окружающую среду. Во-первых, повышение концентрации диоксида серы в атмосферном воздухе приводит к раздражению слизистых оболочек (глаз, органов дыхания) живых существ, включая человека, вплоть до возникновения хронических респираторных заболеваний. Во-вторых, диоксид серы в атмосфере под действием озона, образующегося из кислорода воздуха в результате солнечной радиации, окисляется до триоксида серы SO3:
SO2 + О3 SO3 + О2.
Последний мгновенно соединяется с водяным паром воздуха и образует пары серной кислоты.
Озон окисляет также оксиды азота до высших окислов с конечным образованием паров азотной кислоты.
Азотная кислота HNO3, бесцветная жидкость с резким удушливым запахом; плотность 1,513 г/см3, tпл = - 41,59 °C, tкип = 82,6 °C. С водой смешивается во всех отношениях. В промышленности получают каталитическим окислением аммиака. Применяют для получения удобрений, нитратов целлюлозы, красителей, серной кислоты, для травления металлов и полупроводниковых материалов, как окислитель ракетного топлива, компонент «нитрующей смеси» (с серной кислотой). Соли и эфиры азотной кислоты нитраты.
Пары обеих кислот имеют плотность в 3 4 раза больше плотности воздуха, что обеспечивает их интенсивное гравитационное осаждение. Атмосферные осадки ускоряют поступление этих кислот в почву. Процесс вымывания из атмосферы кислых компонентов, в том числе и дымовых газов, называют кислотными или кислыми дождями. В результате пресноводные водоемы и реки быстро закисляются, что приводит к гибели части водной флоры и фауны или замене их другими, более стойкими формами, но не обеспечивающими необходимую регенерацию воды. К этому следует добавить, что смесь серной и азотной кислот по своей способности растворять тяжелые металлы приближается к «царской водке». В результате смесь серной и азотной кислот постоянно растворяет тяжелые металлы и с грунтовыми водами вносит их в пресную воду и отравляет, таким образом, живые организмы, включая человека.
Регенерация восстановление, возобновление, возмещение чего–нибудь в процессе развития, деятельности, обработки.
Поведение диоксида серы в воздухе характеризуется следующим. Расчеты показывают, что примерно 90 % SO2 выпадает из дымовых газов на почву в радиусе примерно 15 35 высот дымовых труб. Этим объясняется принятое в большинстве промышленно развитых стран законодательство по диоксиду серы: обеспечивать не только технически достижимое содержание SO2 в выбрасываемых в воздух газах, но и степень его улавливания (около 60% для котлов малой мощности и 90 % для котлов большой мощности). И только 10 % SO2 переносятся в другие регионы под действием атмосферных потоков.
Если учесть, что скорости осаждения диоксида серы и субмикронных частиц летучей золы (наиболее обогащенных тяжелыми металлами) практически одинаковы, то закисление пресных водоемов и подземных вод и загрязнение их тяжелыми металлами происходят одновременно. Поэтому предотвратить этот процесс можно лишь уменьшением выбросов диоксида серы до значений, не снижающих регенеративных возможностей природы.
Таким образом, действие диоксида серы проявляется двояко: он интенсивно загрязняет район размещения тепловой электростанции и стимулирует через кислотные дожди интенсивное поступление тяжелых металлов в пресные водоемы и в почвы, а значит и в сельскохозяйственные продукты.
В атмосферном воздухе диоксид серы «живет» до 3 суток и весь выпадает на растительность, здания, почву и в природные водоемы.
В любом органическом топливе, кроме природного газа, содержится сера. Она существует либо как составная часть органической части топлива (органическая сера), либо в виде колчедана FeS2, входящего в минеральную часть топлива.
Колчеданы общее название руд, состоящих преимущественно из сернистых (сульфидных) минералов. Сырье для извлечения Cu, Zn, Pb, получения серной кислоты и др.
При окислительном сжигании из серы топлива образуются диоксид и триоксид серы:
S + О2 = SO2;
2FeS2 + 5O2 = 2FeO + 4SO2.
При восстановительном сжигании для получения генераторного газа образуется сероводород H2S, который затем сгорает, превращаясь в итоге в тот же диоксид:
H2S + 3О2 2SO2 + 2Н2О.
Сероводород H2S, бесцветный газ с запахом тухлых яиц; tпл = -85,54 °С, tкип = -60,35 °С; при 0 °С сжижается под давлением 1 МПа. Восстановитель. Побочный продукт при очистке нефтепродуктов, коксовании угля и др.; образуется при разложении белковых веществ. Содержится в некоторых минеральных водах и лечебных грязях. Применяется в производстве серы, серной кислоты, сульфидов, в органическом синтезе, химическом анализе, для приготовления лечебных сероводородных ванн. Ядовит.
Концентрация диоксида серы SO2, в дымовых газах равна примерно 0,02 0,5 %, и, как уже указывалось, собственно это вещество не влияет на процесс производства энергии. В процессе горения топлива часть диоксида серы окисляется до триоксида SO3:
2SO2 + О2 = 2SO3.
Количество триоксида в дымовых газах вследствие сорбции этого вещества поверхностями нагрева котла и золой (последняя особенно активно поглощает триоксид серы в электрическом поле) снижается по газоходам котельной установки, так что его концентрация перед дымовой трубой не превышает обычно 10 ррm.
При наличии в газовой фазе водяных паров триоксид серы мгновенно образует серную кислоту, обычно в виде паров:
SO3 + Н2О = H2SO4.
Хотя концентрация этого вещества в дымовых газах невелика (5 60 ррm), она обусловливает сернокислотную точку росы, по которой выбирают температуру уходящих дымовых газов, определяющую тепловую эффективность котла. Сернокислотная точка росы является также одним из основных факторов, обеспечивающих эффективную работу электрогазоочистки.
Так что сейчас с учетом всех последствий от ненормированного попадания диоксида серы в окружающую среду современной считают такую ТЭС, которая имеет необходимые газоочистные сооружения, обеспечивающие производство экологически чистой энергии.
Географически месторождения высокосернистых углей в России находятся в европейской части страны и на Урале. Угли Сибири и Дальнего Востока имеют обычно малое содержание серы. Отечественные энергетические мазуты содержат 2 3,5 % серы. Попытка организовать в конце 80-х годов XX в. Производство малосернистых мазутов с содержанием серы около 0,5 % для сезонного сжигания в качестве резервного топлива оказалась неудачной из-за перехода нефтеперерабатывающей промышленности на углубленное извлечение светлых легких фракций.
По санитарно-гигиеническому законодательству России в атмосферном воздухе должны соблюдаться следующие предельно допустимые концентрации диоксида серы:
максимальноразовая (за время отбора пробы 20 мин) 0,5 мг/м3;
среднесуточная 0,05 мг/м3.
В воздухе рабочих помещений концентрация диоксида серы не должна превышать 10 мг/м3.
Первая попытка ограничить концентрацию SO2 была предпринята в 1986 г., когда для котельных установок тепловой мощностью менее 300 МВт был установлен удельный выброс, равный 0,25 г/МДж (приблизительно 600 мг/м3 при = 1,4), а для котлов тепловой мощностью 300 МВт и более 0,175 г/МДж (приблизительно 400 мг/м3 при = 1,4).
В 1995 г. был выпущен ГОСТ Р 5083195 «Установки котельные. Тепломеханическое оборудование. Общие технические требования» (М.: Госстандарт России, 1995). Согласно его требованиям вновь сооружаемые и реконструируемые котельные установки начиная с 01.01.2001 г. должны обеспечивать нормативы удельных выбросов диоксида серы, которые зависят от тепловой мощности котлов и от приведенной сернистости сжигаемого топлива Sп.
С 1 июля 2004 г. для действующих ТЭС европейской части страны вводятся нормативы II Протокола к Международной конвенции о трансграничном переносе (МКТП) диоксида серы.
Каждая страна, подписавшая Протокол и Международную конвенцию, может выбрать ограничение по выбросам диоксида серы в виде концентрации этого вещества в газах, выходящих из котла, или в виде степени очистки дымовых газов каждого котла. Для России приняты значения концентраций.
Сравнение этих нормативов с требованиями ГОСТ Р 5083195 показано на рис. 5.
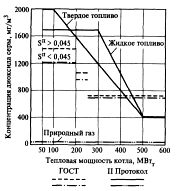
Рис. 5. Сравнение концентраций SO2 по ГОСТ Р 50831 95 и II Протоколу к Международной конвенции о трансграничном переносе диоксида серы
Видно, что эти нормативы для котлов тепловой мощностью до 450 МВт менее жесткие. И только для котлов мощностью более 450 МВт необходимо обеспечить удельный выброс 0,175 г/МДж вместо 0,3 г/МДж.
Поскольку диоксид серы является кислым газом, то его связывание до нейтральных соединений возможно с применением реагентов на основе щелочных (натрий, калий) или щелочноземельных (кальций, магний) элементов.
Природными реагентами являются только кальцит СаСО3, магнезит MgCO3 и доломит CaMg(CO3)2.
Кальцит в природе представлен широким классом минералов:
мелом, который имеет аморфную структуру;
мрамором, который имеет кристаллическую структуру;
известняками, кристаллическая структура которых занимает промежуточное положение между мелом и мрамором; более древние известняки приближаются к мрамору, а менее древние к мелу.
Известняк осадочная горная порода, состоящая главным образом из кальцита, редко из арагонита; часто с примесью доломита, глинистых и песчаных частиц. Известняки нередко содержат остатки известковых скелетов ископаемых организмов. Используется в металлургии (флюсы), строительстве, химической промышленности и др.
Кальцит имеет следующие свойства:
плотность 2,72 г/см3;
температуру плавления приблизительно 1200 °С;
температуру разложения 850 °С при давлении около 105 Па и 650 °С при давлении около 8105 Па;
растворимость в воде 14 мг/л [в присутствии СО2 растворимость резко возрастает вследствие образования Са(НСО3)2].
Магнезит имеет плотность 2,9 3,1 г/см3 и в воде растворяется около 0,5 г/л; плотность доломита равна 2,85 г/см3.
К искусственным реагентам относятся: производные кальцита известь гашеная Са(ОН)2 и негашеная СаО;
производные магнезита оксид магния MgO и гидроксид магния Mg(OH)2;
сода каустическая NaOH, питьевая NaHCO3, карбонатная Na2CO3 (в природе Na2CO3 существует в виде троны, натрона и термонатрита);
поташ К3СО3;
аммиак NH3 и аммиачная вода NH4OH.
Известь обобщенное название продуктов обжига (и последующей переработки) известняка, мела и других карбонатных пород. Различают известь негашеную (СаО), гашеную [Ca(OH)2], натронную (смесь гашеной извести с NaOH) и др. Известь используют в строительстве (для приготовления кладочных и штукатурных растворов, силикатных бетонов), сельском хозяйстве (для известкования почв) и т. д.
При этом не рассматривались некоторые химические вещества, имеющие щелочные свойства, которые могут образовываться в тех или иных химических производствах, поскольку их количество обычно невелико и требует специальной проверки на пригодность для целей сероочистки.
Степень улавливания диоксида серы рассчитывают по разности масс этого вещества после котла G1 и перед дымовой трубой G2 (%):
![]() (15)
(15)
Поскольку масса диоксида серы (кг/ч):
![]() ,
,
где В
расход топлива, кг/ч; Vг
объем дымовых газов, образующихся при
сжигании 1 кг топлива, нм3/кг;
![]()
массовая концентрация диоксида серы,
кг/нм3,
то это выражение принимает вид (%):
массовая концентрация диоксида серы,
кг/нм3,
то это выражение принимает вид (%):
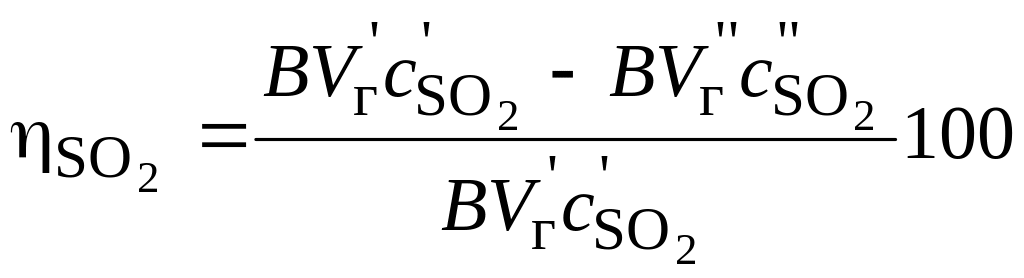 (16)
(16)
или после сокращения в формуле (16) значения расхода топлива (%):
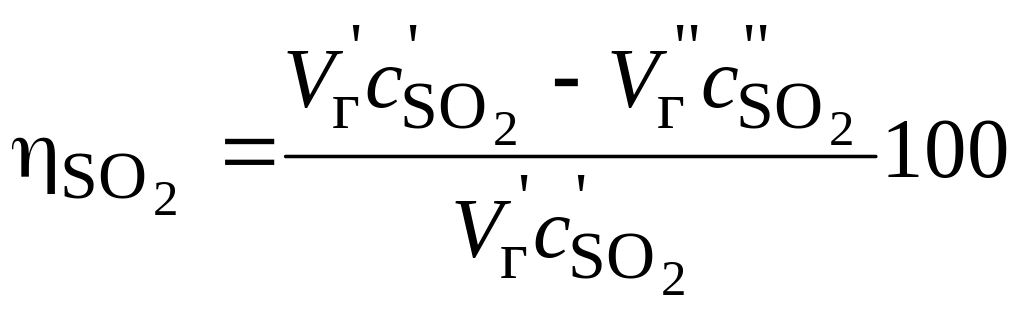 .
(17)
.
(17)
Разделим числитель и
знаменатель последнего выражения на
низшую теплотворность топлива
(МДж/кг),
и если учесть, что удельный выброс
![]() (г/МДж),
то получим выражение для определения
степени сероочистки через удельные
выбросы (%):
(г/МДж),
то получим выражение для определения
степени сероочистки через удельные
выбросы (%):
![]() ,
(18)
,
(18)
где п’ и п’’ удельный выброс диоксида серы соответственно из котла и регламентированный санитарным законодательством.
Из приведенных формул видно, что другие способы расчета, в частности только через концентрации без учета присосов воздуха, неправомочны.
Сейчас содержание диоксида серы обычно измеряют различными переносными приборами с электрохимическими ячейками. Особенность этих приборов состоит в том, что без специальной пробоподготовки нельзя измерять концентрацию диоксида серы в охлажденных и увлажненных газах. Сравнение результатов измерений такими приборами без пробоподготовки и при классических мокрых аналитических способах показывает, что в первом случае результаты оказываются ниже фактических значений в 2 раза и более. Показания автоматических (и переносных) приборов необходимо также соотносить со свойствами реагентов, применяемых для очистки дымовых газов.
