
- •1)Электромагнитная природа света.Световые волны.Волновое уравнение и простейшие модели световых волн, вытекающие из уравнений максвелла: плоская бегущая волна,сферическая волна.
- •2) Основные характеристики плоских монохроматических волн: фазовая скорость, плотность энергии, интенсивность, поляризация.
- •4) Понятие о временной и пространственной когерентности световых волн.
- •5)Интерференция света: условия и способы наблюдения (опыт юнга, интерферометр майкельсона, интерференция при отражении от тонких пленок).
- •6) Дифракция света: принцип гюйгенса-френеля, дифракция френеля, дифракция фраунгофера.
- •7) Дифракционная решетка.Понятие о голографии.
- •[Править]Формулы
- •7А)явление обращения волного фронта. Понятие об адаптивной оптике.
- •[Править]Методы обращения волнового фронта
- •Вопрос 8. Явление дисперсии и поглощения волн. Понятие о молекулярном рассеянии света.
- •Вопрос 10. Поляризация света.
- •Вопрос 11. Тепловое излучение в замкнутой полости. Закон Кирхгофа. Закон Стефана Больцмана и Вина. Формула Планка.
- •Вопрос 12. Понятие фотона. Фотоэффект и эффект Комптона. Давление света.
- •13)Физические предпосылки возникновения квантовой механики(проблемы не разрешимые классической физикой).Постулаты бора.
- •14)Волны де-бройля.Соотношение неопределенностей гейзенберга. Во́лны де Бро́йля — волны, связанные с любыми микрочастицами и отражающие их волновую природу. Физический смысл
- •Вопрос 15. Постулаты квантовой механики.
- •Получение уравнения Шрёдингера предельным переходом [источник не указан 56 дней]
- •Вопрос 17. Операторы важнейших физических величин: оператор импульса, проекции момента импульса, оператор квадрата момента импульса. Законы сохранения в квантовой физики.
- •Вопрос 18. Квантование момента импульса. Опыт Штерна-Герлаха. Спин.
- •Вопрос 19. Квантомеханическое движение частицы в бесконечно глубокой прямоугольной потенциальной яме.
- •Вопрос 20. Прохождение частиц через потенциальный барьер ( туннельный эффект).
- •Вопрос 21. Квантовый гармонический осциллятор.
- •Вопрос 22. Квантомеханическое описание атома водорода.
- •Вопрос 23. Принцип тождественных частиц. Принцип Паули. Фермионы и бозоны.
Вопрос 22. Квантомеханическое описание атома водорода.
В 1924 г. французский физик Луи де Бройль высказал идею о том, что материя обладает как волновыми, так и корпускулярными свойствами. Согласно уравнению де Бройля (одному из основных уравнений квантовой механики),
![]()
т. е. частице с массой m, движущейся со скоростью v соответствует волна длиной λ; h — постоянная Планка.
Длину волны такой частицы называют длиной волны де Бройля. Для любой частицы с массой т и известной скоростью v длину волны де Бройля можно рассчитать. Идея де Бройля была экспериментально подтверждена в 1927 г., когда были обнаружены у электронов как волновые, так и корпускулярные свойства. В 1927 г. немецким ученым В. Гейзенбергом был предложен принцип неопределенности, согласно которому для микрочастиц невозможно одновременно точно определить и координату частицы X, и составляющую рх импульса вдоль оси х. Математически принцип неопределенности записывают следующими уравнениями:
ΔxΔpx ≥ h;
ΔxΔpy ≥ h;
ΔxΔpz ≥ h.
Отсюда следует, что при точном определении координаты х микрочастицы исчезает информация о ее импульсе Δpx, так как при х=0 величина Δpx→∞. Если удастся снизить погрешность Δp,то будет велика погрешность Δх. Источник этих погрешностей заключен не в приборах, а в самой природе вещей.
Поскольку постоянная Планка очень мала, то ограничения, накладываемые принципом неопределенности, существенны только в масштабах атомных размеров. Согласно принципу неопределенности, невозможно утверждать, что электрон, имеющий определенную скорость, находится в данной точке пространства, здесь можно использовать лишь вероятностное описание.
Для описания свойств электрона используют волновую функцию, которую обозначают буквой Ψ (пси). Квадрат ее модуля |Ψ|2, вычисленный для определенного момента времени и определенной точки пространства, пропорционален вероятности обнаружить частицу в этой точке в указанное время. Величину |Ψ|2 называют плотностью вероятности. Наглядное представление о распределении электронной плотности атома дает функция радиального распределения. Такая функция служит мерой вероятности нахождения электрона в сферическом слое между расстояниями r и (r+dr) от ядра. Объем, лежащий между двумя сферами, имеющими радиусы r и (r+dr), равен 4Πr2dr, а вероятность нахождения электрона в этом элементарном объеме может быть представлена графически в виде зависимостей функции радиального распределения. На рис. 1 представлена функция вероятности для основного энергетического состояния электрона в атоме водорода. Плотность вероятности |Ψ|2достигает максимального значения на некотором конечном расстоянии от ядра. При этом наиболее вероятное значение r для электрона атома водорода равно радиусу орбиты a0 соответствующей основному состоянию электрона в модели Бора. Различная плотность вероятности дает представление об электроне, как бы размазанном вокруг ядра в виде так называемого электронного облака (рис. 2).
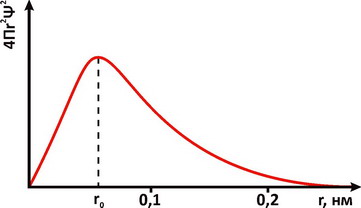
Рис. 1. Радиальное распределение вероятности пребывания электрона для основного энергетического состояния атома водорода
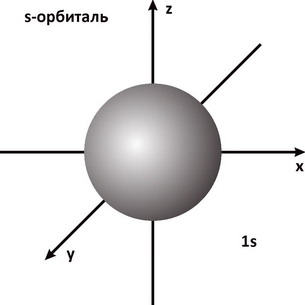
Рис. 2. Электронное s-облако (l - 0)
Чем больше величина |Ψ|2, тем больше вероятность нахождения электрона в данной области атомного пространства.
В квантовой механике вместо термина «орбита» используют термин «орбиталь», которым называют волновую функцию электрона. Соответственно орбиталь характеризует и энергию и форму пространственного распределения электронного облака. Расчеты в квантовой механике проводят с помощью предложенного в 1926 г. австрийским ученым Э. Шредингером уравнения, которое является математическим описанием электронного строения атома в трехмерном-пространстве.
В простейшем случае уравнение Шредингера может быть записано в виде
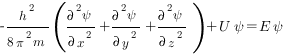
где h — постоянная Планка; m — масса частицы; U — потенциальная энергия; Е — полная энергия; х, у, z — координаты; Ψ — волновая функция.
Решая уравнение Шредингера, находят волновую функцию Ψ=f(x, y, z). Решение уравнения Шредингера возможно лишь при определенных значениях полной энергии Е. Определив вероятностную функцию можно оценить величину |Ψ|2dV — вероятность нахождения электрона в объеме пространства dV, окружающего атомное ядро. Решение уравнения Шредингера представляет сложную математическую задачу.
