
- •Лекция №1 Введение
- •Лекция №2
- •Равновесие химико-технологических процессов.
- •Количественная оценка смещения равновесия.
- •Лекция №3 Кинетика химических реакций
- •Скорость необратимых реакций
- •Обратимые реакции
- •Лекция №4 Определение оптимальной и равновесной температур для обратимых реакций.
- •Определение оптимальной температуры.
- •2. Определение равновесной температуры.
- •Управление скоростью реакции, протекающей по законам формальной кинетики.
- •Лекция №5
- •Управление состоянием равновесия и скоростью сложных процессов.
- •Влияние температуры, давления и концентрации на скорость параллельных реакций.
- •Лекция №6 Моделирование химического реактора.
- •Лекция №7 Реакторы
- •Модель реактора идеального вытеснения
- •Модель реактора полного смешения
- •Лекция №8
- •Рассматриваем экзотермическую реакцию.
- •Лекция №9 Адиабатический температурный режим.
- •Тепловой эффект химической реакции.
- •Лекция №10 Сравнение адиабатических реакторов при проведении эндотермической реакции.
- •С равнение реакторов при проведении экзотермической реакции.
- •Лекция №11 Оптимизация работы единичного реактора по экономическим критериям
- •Лекция № 11 Гетерогенные процессы.
- •Лекция №12 Внешняя диффузная область протекания гетерогенного процесса в системе газ/твердое вещество.
- •Внутренняя диффузная область протекания гетерогенного процесса в системе газ/твердое вещество.
- •Кинетическая область протекания гетерогенного процесса в системе газ/твердое вещество.
Равновесие химико-технологических процессов.
Известно, что в зависимости от условий проведения, рассматриваемые химические взаимодействия могут протекать как в сторону образования продуктов, так и в сторону образования исходных веществ.
Если скорость образования продукта численно равна скорости образования исходных веществ, то рассматриваемая система находится в состоянии равновесия.
На самом деле, состояние равновесия – гипотетическое состояние. С точки зрения оформленных процессов он очень важен. Мы можем бесконечно близко подойти к состоянию равновесия, но его не достигнуть. Нам интересно, где оно и как к нему подойти.
В технологическом процессе необходимо научиться управлять состоянием равновесия.
Чтобы сместить равновесие в сторону продуктов, производительность должна быть равна 1. За счет равновесия мы можем блокировать побочные реакции.
Состояние равновесия характеризуется следующими свойствами:
Неизменность при постоянств вешних условий.
Подвижность равновесия – свойство открыто одновременно двумя учёными и носит название Ле–Шателье–Брауна.
Формулировка: если систему, находящуюся в равновесии, подвергнуть какому – либо внешнему воздействию, то система будет компенсировать это внешнее воздействие.
На основании принципа Ле–Шателье–Брауна можно спрогнозировать смещение равновесия для единичной реакции. Если же реакций несколько – только считать.
Если реакция экзотермическая, то при повышении температуры равновесие смещается в сторону исходных веществ. Система стремится компенсировать повышение температуры за счет уменьшения выделяемой теплоты. Аналогично, если реакция эндотермическая, то при повышении температуры, равновесие смещается в сторону продуктов реакции.
Если реакция протекает с уменьшением объема газообразных реагентов, то при повышении давления, равновесие смещается в сторону продуктов реакции. Если реакция протекает с увеличением объема газообразных реагентов, то при повышении давления, равновесие смещается в сторону исходных веществ. Если реакция протекает без изменения объема газообразных реагентов, то изменение давления не влияет на изменение состояния равновесия.
Введение в реакционную смесь дополнительного количества исходных веществ смещает равновесие в сторону образования продуктов и наоборот. Введение в реакционную смесь дополнительного количества продуктов смещает равновесие в сторону исходных веществ.
Введение в реакционную смесь дополнительного количества инерта смещает равновесие в сторону образования продуктов, если реакция протекает с увеличением объема газообразных реагентов и в сторону исходных веществ, если реакция протекает с уменьшением объема газообразных реагентов.
То есть, о единичной реакции мы можем говорить, куда будет смещаться равновесие и насколько.
Состояние равновесия
В состоянии равновесия свободная энергия реагирующей системы равно 0. Свободная энергия реагирующей системы: для изобарно - изотермического процесса ∆G=0, для изохорно - изотермического ∆F=0.
Количественная оценка смещения равновесия.
aA + bB = cC + dD
∆G = d·µD+c·µC+a·µА+b·µВ
где µ – химический потенциал;
для любого i-ого вещества: µ=µi°+R∙T∙lnPi;
µi° – химический потенциал в стандартных условиях:
Pi=P·Zi – закон Дальтона;
P – общее давление;
Zi – мольная доля i-ого компонента.
∆G
= d·µD
+
c·µC
-
a·µА
-
b·µВ
+ RT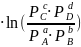
d·µD + c·µC - a·µА - b·µВ = ∆G°
∆ G
= ∆G°+ RT
G
= ∆G°+ RT
U = U => U=U – U=0 , отсюда, на основании закона действующих масс:
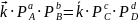
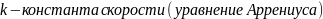
 отношение
констант скорости прямой и обратной
реакций равно отношению парциальных
давлений
отношение
констант скорости прямой и обратной
реакций равно отношению парциальных
давлений
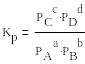
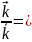 Kp–
термодинамическая константа равновесия,
то есть:
Kp–
термодинамическая константа равновесия,
то есть:
Отсюда, использование закона Дальтона:
 Уравнение
расчета равновесных мольных долей
компонентов.
Слева
– неизвестные, справа – известные.
Численная
оценка смещения равновесия при изменении
внешних условий.
Уравнение
расчета равновесных мольных долей
компонентов.
Слева
– неизвестные, справа – известные.
Численная
оценка смещения равновесия при изменении
внешних условий.
Используя эти данные и третье свойство равновесия:
0 = ∆G° + R T lnKp , отсюда
lnKp
=
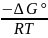
∆G°
= ∆H°-T∆S°
=> lnKp
=
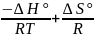
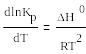
уравнение изобары Вант-Гоффа
Исходя из этого уравнение, мы можем сделать вывод:
Е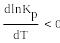 сли
реакция экзотермическая, то ∆H°<0
=>
сли
реакция экзотермическая, то ∆H°<0
=>
и с повышением температуры Kp будет уменьшаться
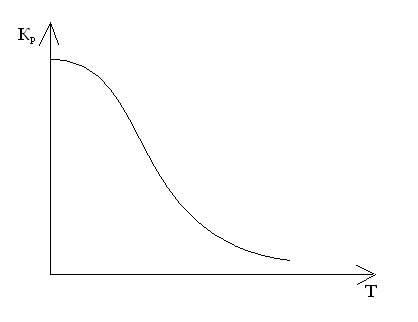
Е
с повышением температуры Kp будет увеличиваться
сли же реакция эндотермическая, то ∆H°>0 =>
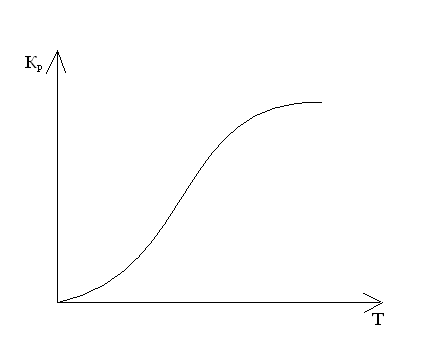
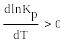
Е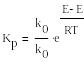 сли
же вернуться к соотношению:
Kp,
то
мы получим:
сли
же вернуться к соотношению:
Kp,
то
мы получим:
П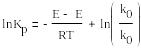 осле
логарифмирования получаем:
осле
логарифмирования получаем:
Таким образом, ∆H°=E-E – изменение энтальпии реакции при стандартных условиях есть разность энергий активации прямой и обратной реакции, отсюда выводы:
Д ля экзотермической реакции Е < Е , для эндотермической реакции наоборот Е > E
И зменение Е влечет за собой изменение Е
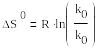
изменение энтропии реакции
Т.е. предэкспоненциальный множитель в уравнении Аррениуса связан с изменением энтальпии реакции.
