
- •Лекция №1 Введение
- •Лекция №2
- •Равновесие химико-технологических процессов.
- •Количественная оценка смещения равновесия.
- •Лекция №3 Кинетика химических реакций
- •Скорость необратимых реакций
- •Обратимые реакции
- •Лекция №4 Определение оптимальной и равновесной температур для обратимых реакций.
- •Определение оптимальной температуры.
- •2. Определение равновесной температуры.
- •Управление скоростью реакции, протекающей по законам формальной кинетики.
- •Лекция №5
- •Управление состоянием равновесия и скоростью сложных процессов.
- •Влияние температуры, давления и концентрации на скорость параллельных реакций.
- •Лекция №6 Моделирование химического реактора.
- •Лекция №7 Реакторы
- •Модель реактора идеального вытеснения
- •Модель реактора полного смешения
- •Лекция №8
- •Рассматриваем экзотермическую реакцию.
- •Лекция №9 Адиабатический температурный режим.
- •Тепловой эффект химической реакции.
- •Лекция №10 Сравнение адиабатических реакторов при проведении эндотермической реакции.
- •С равнение реакторов при проведении экзотермической реакции.
- •Лекция №11 Оптимизация работы единичного реактора по экономическим критериям
- •Лекция № 11 Гетерогенные процессы.
- •Лекция №12 Внешняя диффузная область протекания гетерогенного процесса в системе газ/твердое вещество.
- •Внутренняя диффузная область протекания гетерогенного процесса в системе газ/твердое вещество.
- •Кинетическая область протекания гетерогенного процесса в системе газ/твердое вещество.
Лекция №2
Степень превращения – отношение количества вещества, вступившего в реакцию к начальному количеству вещества.
В том случае, если исходные реагенты находятся в стехиометрическом соотношении, степени превращения по реагентам совпадают.
В подавляющем большинстве случаев реагенты подаются в нестехиометрическом соотношении, поэтому практическую ценность имеет степень превращения вещества, находящегося в недостатке.
Выход продукта – отношение производительности по продукту к максимально возможной производительности по рассматриваемому веществу.
В принципе, выход по продукту численно совпадает со степенью превращения ключевого компонента. Степень превращения обозначается Х, а выход продукта – f с подстрочным индексом, указывающим на вещество, по которому взят это показатель.
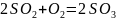 ,
ХSO2,
fSO3.
,
ХSO2,
fSO3.
Расходный коэффициент – это количество исходного реагента, которое необходимо для производства единицы количества продукта.
Различают теоретический расходный коэффициент, который рассчитывается на основании стехиометрического уравнения и практический расходный коэффициент, который учитывает чистоту сырья и степень превращения сырья.
Теоретический расходный коэффициент рассчитывается:
по SO2
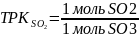
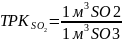
Для технических расчетов принимаем, что газы SO2 и SO3 идеальны, то 1 кмоль занимает объем 44.8 м3.
Таким образом, отношение заменяют отношением молярных масс.
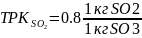 0.8=64/80
(отношение молярных масс)
0.8=64/80
(отношение молярных масс)
Селективность – величина, которая используется в том случае, если в реакторе могут протекать одновременно 2 и более реакции.
Интегральная селективность – это отношение производительности по ключевому компоненту в целевой реакции к суммарной производительности по ключевому компоненту по всем реакциям, протекающим в реакционном объеме.
Величина интегральной селективности может меняться от 0 до 1. Если интегральная селективность равна единице, то все побочные реакции заблокированы. Если она равна нулю, то не протекает целевая реакция.
I. 4NH3+5O2=4NO+6H2O
II. 4NH3+3O2=2N2+6H2O
Система в упрощенном виде для процесса окисления NH3 в производстве азотной кислоты. Очевидно, что I реакция является целевой, поскольку получается оксид азота, который в дальнейшем превращается в диоксид и адсорбируется с образованием азотной кислоты. II реакция – побочная, так как с трудом полученный аммиак расходуется на производство азота, который используется при синтезе аммиака.
Здесь селективность – это производительность по NH3 I реакции, отнесенная к производительности по NH3 в I реакции и производительности по NH3 во II реакции:
Селективность
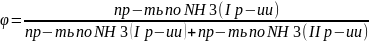
В производстве азотной кислоты считается приемлемым, если селективность получается в порядке 0.94.
Такая селективность достигается двумя путями:
Использование селективных катализаторов.
В настоящее время в реакторах окисления SO2 используют два катализатора.
1 секция – стандартные традиционные катализаторы в виде платиновых сеток.
секция - блочные катализаторы ИК42, активный компонент-железо.
Увеличив концентрацию О2 мы увеличим производительность по первой реакции, но уменьшим концентрацию NH3. Поэтому надо искать оптимальную концентрацию О2.
Дифференциальная
селективность
– отношение скорости целевой реакции
к сумме скоростей всех реакций, протекающих
в реакционном объеме. Меняется в интервале
от 0 до 1 и обозначается
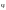 ’.
’.
Производительность – изменение количества вещества в единицу времени. Производительность по веществу – разность между конечным и начальным количеством вещества.
