
- •1.Кинематика. Перемещение, скорость, ускорение.
- •2.Законы Ньютона
- •3.Закон сохранения импульса
- •4.Работа, кинетическая энергия
- •5.Потенциальные силы, потенциальная энергия, закон сохранения энергии
- •6.Гравитационное поле, потенциальная энергия гравитационного поля
- •7.Центральный удар, абсолютно упругий и абсолютно неупругий удар
- •8.Вращательное движение, угловая скорость, угловое ускорение
- •9.Момент инерции, момент сил, закон вращательного движения
- •10.Термодинамическое уравнение состояния идеального газа
- •11.Кинетическое уравнение состояния идеального газа, внутренняя энергия
- •12.Барометрическая формула Больцмана
- •13.Распределение Максвелла
- •14.Броуновское движение
- •15.Первое начало термодинамики. Работа, теплота ,внутренняя энергия.
- •16.Изобарический и изохорические процессы, теплоемкость в таких процессах
- •17.Изотермический и адиабатический процессы: реализация, работа и уравнения
- •18.Второе начало термодинамики, формулировки Томпсона и Клаузиуса
- •19.Цикл Карно
- •Описание цикла Карно:
- •20.Энтропия: определение, закон возрастания энтропии
- •21.Процессы переноса, законы Фика и Фурье
- •22.Закон Кулона, напряженность электрического поля, закон суперпозиции
- •23.Опыт Милликена, заряд электрона.
- •24.Поле электрического диполя
- •25.Теорема Гаусса, примеры ее применения
- •26.Потенциал электрического поля
- •27.Проводники и диэлектрики во внешнем поле
- •28.Диэлектрики, диэлектрическая проницаемость, восприимчивость и вектор поляризации
- •29.Электрическое поле на границе диэлектриков
- •30.Электрическая ёмкость проводника, конденсатор
- •31.Энергия электрического поля
11.Кинетическое уравнение состояния идеального газа, внутренняя энергия
Вну́тренняя эне́ргия тела (обозначается как E или U) — полная энергия этого тела за вычетом кинетической энергии тела как целого и потенциальной энергии тела во внешнем поле сил. Следовательно, внутренняя энергия складывается из кинетической энергии хаотического движения молекул, потенциальной энергии взаимодействия между ними и внутримолекулярной энергии.
Изменение внутренней энергии при переходе из одного состояния в другое будет всегда равно разности между ее значениями в конечном и начальном состояниях, независимо от пути, по которому совершался переход.
Внутреннюю
энергию тела нельзя измерить напрямую.
Можно определить только изменение
внутренней энергии:![]() ,
где
,
где
![]() —
подведённая к телу теплота,
измеренная в джоулях,
—
подведённая к телу теплота,
измеренная в джоулях,
![]() —
работа,
совершаемая телом против внешних сил,
измеренная в джоулях
—
работа,
совершаемая телом против внешних сил,
измеренная в джоулях
Эта формула является математическим выражением первого начала термодинамики
Идеальные
газы:
согласно
закону Джоуля, выведенному эмпирически,
внутренняя энергия идеального
газа
не зависит от давления или объёма. Исходя
из этого факта, можно получить выражение
для изменения внутренней энергии
идеального газа. По определению молярной
теплоёмкости
при постоянном объёме,
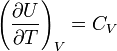 .
Так как внутренняя энергия идеального
газа является функцией только от
температуры, то
.
Так как внутренняя энергия идеального
газа является функцией только от
температуры, то
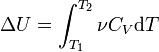 .
.
Эта же формула верна и для вычисления изменения внутренней энергии любого тела, но только в процессах при постоянном объёме (изохорных процессах); в общем случае CV(T,V) является функцией и температуры, и объёма.
Если пренебречь изменением молярной теплоёмкости при изменении температуры, получим:
ΔU = νCVΔT,
где ν — количество вещества, ΔT — изменение температуры.
12.Барометрическая формула Больцмана
Барометрическая
формула- зависимость давления
или плотности газа от высоты в поле
тяжести. Для идеального
газа, имеющего постоянную
температуру T и находящегося в
однородном поле тяжести (во всех точках
его объёма ускорение
свободного падения g
одинаково).
Если температура не
зависит от высоты, то давление газа
меняется с высотой по закону:
![]() ,
где
,
где![]() —
высота,
—
высота,
![]() —
молярная газовая постоянная,
—
молярная газовая постоянная,
![]() —
постоянная Больцмана,
—
постоянная Больцмана,
![]() —
ускорение свободного падения вблизи
поверхности земли,
—
ускорение свободного падения вблизи
поверхности земли,
![]() —
молярная масса газа,
—
молярная масса газа,![]() —
масса одной молекулы,
—
масса одной молекулы,
![]() —
абсолютная температура.
—
абсолютная температура.
Поделив
барометрическую формулу на
![]() ,
с учетом уравнения состояния идеального
газа, получим распределение Больцмана
— зависимость концентрации молекул от
потенциальной энергии:
,
с учетом уравнения состояния идеального
газа, получим распределение Больцмана
— зависимость концентрации молекул от
потенциальной энергии:
![]() ,
где
,
где
![]() —
потенциальная энергия молекулы. В
однородном поле силы тяжести
—
потенциальная энергия молекулы. В
однородном поле силы тяжести
![]() .
.
13.Распределение Максвелла
Распределение Ма́ксвелла — распределение вероятности, встречающееся в физике и химии. Оно лежит в основании кинетической теории газов, которая объясняет многие фундаментальные свойства газов, включая давление и диффузию. Распределение Максвелла также применимо для электронных процессов переноса и других явлений. Распределение Максвелла применимо к множеству свойств индивидуальных молекул в газе. О нём обычно думают как о распределении энергий молекул в газе, но оно может также применяться к распределению скоростей, импульсов, и модуля импульсов молекул. Также оно может быть выражено как дискретное распределение по множеству дискретных уровней энергии, или как непрерывное распределение по некоторому
Распределение энергии Максвелла может быть выражено как дискретное распределение энергии:
 ,
,
где
![]() является
числом молекул имеющих энергию
является
числом молекул имеющих энергию
![]() при
температуре системы
,
при
температуре системы
,
![]() является
общим числом молекул в системе и
является
общим числом молекул в системе и
![]() —
постоянная
Больцмана. (Отметьте, что
иногда вышеупомянутое уравнение
записывается с множителем
—
постоянная
Больцмана. (Отметьте, что
иногда вышеупомянутое уравнение
записывается с множителем
![]() ,
обозначающим степень вырождения
энергетических уровней. В этом случае
сумма будет по всем энергиям, а не всем
состояниям системы
,
обозначающим степень вырождения
энергетических уровней. В этом случае
сумма будет по всем энергиям, а не всем
состояниям системы
Вывод
распределения по Максвеллу:
Рассмотрим
пространство скоростных точек (каждую
молекулу представляем как точку в
системе координат
![]() )
в стационарном
состоянии
газа. Выберем бесконечно
малый элемент объема
)
в стационарном
состоянии
газа. Выберем бесконечно
малый элемент объема
![]() .
Так как газ стационарный, количество
скоростных точек в
остается
неизменным с течением времени. Пространство
скоростей изотропно,
поэтому функции плотности
вероятности
для всех направлений одинаковы.
.
Так как газ стационарный, количество
скоростных точек в
остается
неизменным с течением времени. Пространство
скоростей изотропно,
поэтому функции плотности
вероятности
для всех направлений одинаковы.
![]()
Максвелл
предположил, что распределения скоростей
по направлениям статистически независимы,
то есть компонента
![]() скорости
молекулы не зависит от
скорости
молекулы не зависит от
![]() и
и
![]() компонент.
компонент.
![]() -
фактически вероятность нахождения
скоростной точки в объеме
.
-
фактически вероятность нахождения
скоростной точки в объеме
.
![]()
![]()
![]()
![]() Правая часть не
зависит от
Правая часть не
зависит от
![]() и
и
![]() ,
значит и левая от
и
не
зависит. Но
и
равноправны,
значит левая часть не зависит также и
от
.
Значит, это константа.
,
значит и левая от
и
не
зависит. Но
и
равноправны,
значит левая часть не зависит также и
от
.
Значит, это константа.
![]()
![]()
![]()
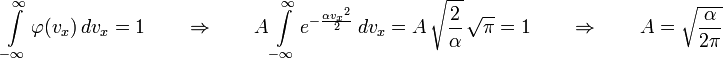
![]()
Теперь нужно сделать принципиальный шаг - ввести температуру. Кинетическое определение температуры (как меры средней кинетической энергии движения молекул):
![]() где
где
![]() Дж/К
- постоянная
Больцмана.
Дж/К
- постоянная
Больцмана.
![]()
Все
направления равноправны:![]()
Чтобы
найти среднее значение
![]() ,
проинтегрируем её вместе с функцией
плотности вероятности от минус до плюс
бесконечности:
,
проинтегрируем её вместе с функцией
плотности вероятности от минус до плюс
бесконечности:
![]()
Отсюда
найдём
![]() :
:![]()
Функция
распределения плотности вероятности
для
(для
и
аналогично):![]()
Рассмотрим
теперь распределение по величине
скорости. Вернемся в пространство
скоростных точек. Все точки с модулем
скорости
![]() лежат
в шаровом слое радиуса
и
толщины
лежат
в шаровом слое радиуса
и
толщины
![]() ,
и
-
объем этого шарового слоя.
,
и
-
объем этого шарового слоя.
![]()
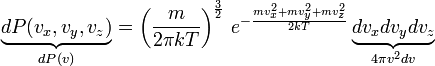
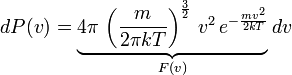 Так,
мы получили
Так,
мы получили
![]() -
функцию плотности вероятности, которая
и называется распределением Максвелла.
-
функцию плотности вероятности, которая
и называется распределением Максвелла.
