
Лекция 1
А)Современное представление о биотехнологии
Основные задачи биотехнологии связаны с получением продуктов с помощью микроорганизмов и других биологических систем, а это возможно только на основе знаний структурно-функциональной организации биологических систем.
Современный этап развития биотехнологии связан, прежде всего, с разработкой новых методов молекулярного клонирования, клеточных технологий и их внедрения в различные направления биотехнологии и проведение фундаментальных исследований биологических систем.
Исследования биологических механизмов дифференцировки, явления тотипотентности, природы стволовых клеток и инженерии и клеточной биологии.
Технология рекомбинантных ДНК и клеточная биотехнология - мощный, эффективный инструмент получения биологических систем с новыми, заданными свойствами. Этот подход открывает принципиально новые возможности в точной диагностике, профилактике и лечении множества инфекционных и генетических заболеваний, что позволяет обеспечить:
значительное повышение урожайности сельскохозяйственных культур путем создания растений, устойчивых к вредителям и негативным факторам среды;
создание микроорганизмов, продуцирующих различные ценные соединения (антибиотики, аминокислоты, ферменты);
создание пород сельскохозяйственных животных с улучшенными признаками;
переработку отходов, загрязняющих окружающую среду;
переработку и модификацию продуктов питания и разработку биологически активных добавок к пище;
решение проблем энергетики и др.
Конечно, реализация этих открывающихся возможностей требует глубоких фундаментальных знаний, привлечения огромных материальных и интеллектуальных ресурсов. Развитие биотехнологии оказывает, а в будущем может привести к глубоким изменениям мировоззрения и этических норм в обществе. Это инициировало формирование биоэтических норм и представлений. Пока остаются без ответа такие важные вопросы: как генетически модифицированные организмы будут вести себя в природной среде; этично ли и правомочно ли использовать технологию рекомбинантных ДНК для человека; не разрушит ли развитие молекулярной биотехнологии традиционное сельское хозяйство; не создадим ли мы новых глобальных проблем, используя технологию рекомбинантных ДНК и т. д. и т. п.
Эти и целый ряд других вопросов рассматриваются на научных форумах, правительственных комиссиях, научных и публичных выступлениях ученых и политических деятелей. Сегодня разрабатываются необходимые правила, инструкции и принципы использования биологических знаний в практической деятельности человека, которые направлены на безопасное развитие биотехнологии.

Б) История развития биотехнологии (допастеровский и послепастеровский периоды)
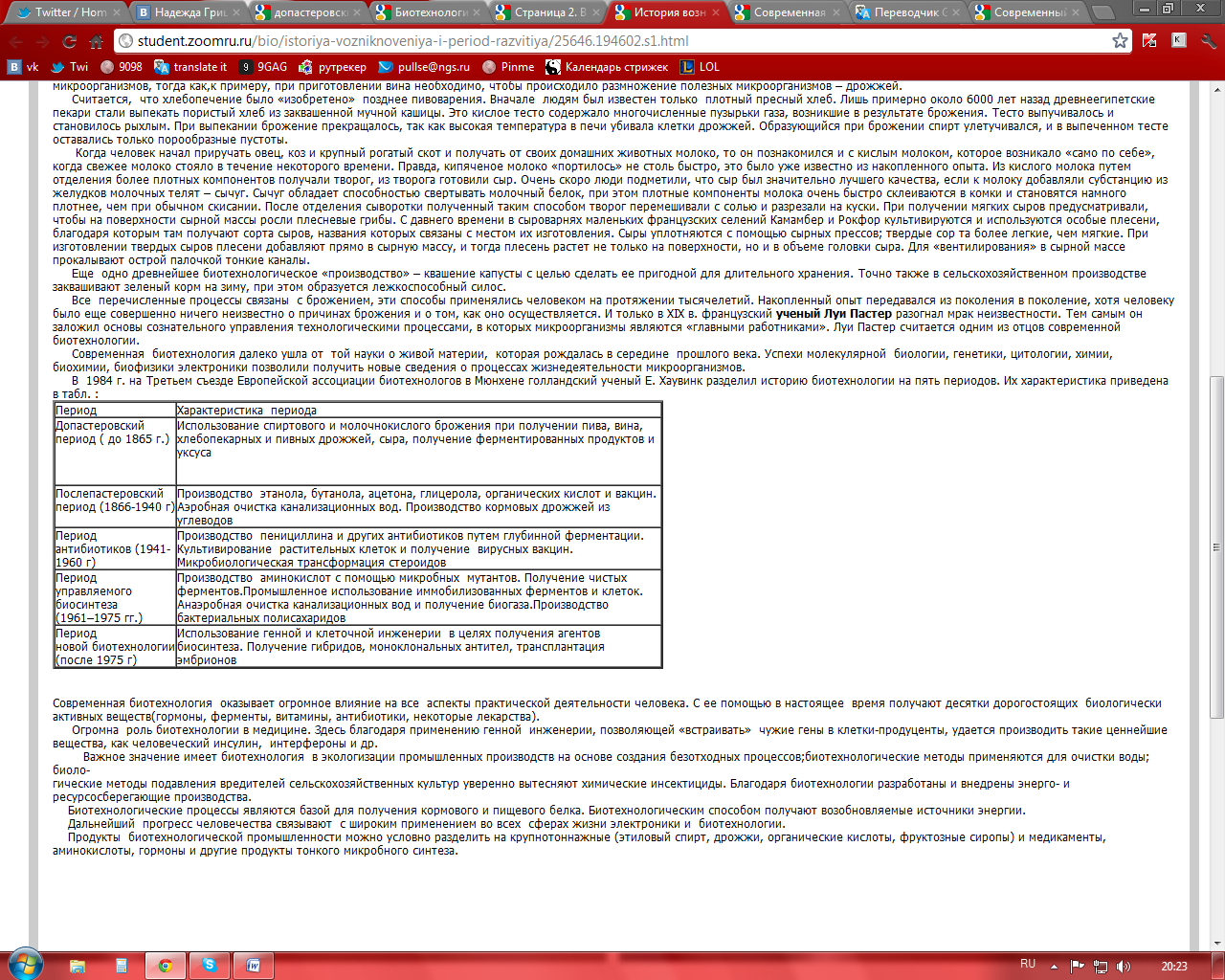
Голландский ученый Е. Хаувинк (1984 г.) предложил разделить историю развития биотехнологии на пять периодов.
Допастеровская эра (до 1865 г.)
Биотехнология возникла в древности (примерно 6000-5000 лет до н.э.), когда люди научились, используя процесс брожения, выпекать хлеб, варить пиво, готовить сыр и вино. При этом наши предки действовали скорее интуитивно, ничего не зная о причинах брожения и о том, как оно осуществляется. Однако опыт получения ферментированных продуктов передавался человеком из поколения в поколение на протяжении тысячелетий. Только в XIX веке французский ученый Луи Пастер установил, что микроорганизмы играют ключевую роль в процессах брожения, и показал, что в образовании отдельных продуктов участвуют разные их виды, которые отличаются не только морфологически, но и особенностями обмена веществ. Таким образом, Луи Пастер заложил основы сознательного управления технологическими процессами, в которых микроорганизмы играют ведущую роль. Он по праву считается одним из отцов современной биотехнологии.
Послепастеровская эра (1866 – 1940 гг.).
Исследования Л. Пастера послужили основой развития в к. XIX – н. XX вв. бродильного производства органических растворителей (этанола, бутанола, ацетона и др.) и других химических веществ, при синтезе которых использовались разные виды микроорганизмов. Во всех этих процессах микробы в анаэробной (бескислородной) среде осуществляют превращение углеводов растений в ценные продукты. В этот период было освоено производство кормовых дрожжей с участием микроорганизмов, где в качестве субстрата использовали углеводороды. Также была разработана аэробная очистка канализационных вод. Были изучены теоретические основы специфики микробиологических процессов при выработке, хранении и созревании молочных продуктов. Создано промышленное производство лимонной кислоты (после того, как советские ученые доказали, что в процессе жизнедеятельности грибов происходит образование органических кислот). В 1919 г. в печати впервые появилось слово «биотехнология», введенное венгерским инженером Карлом Эреки при описании процесса крупномасштабного выращивания свиней с использованием в качестве корма сахарной свеклы. В 1928 г. А. Флеминг открыл пенициллин как антибиотик. Большой вклад в биотехнологические разработки внесли советские исследователи: В.Н. Шапошников, В.С. Буткевич, С.П. Костычев и др.
В) эра антибиотиков и управляемого биосинтеза
Эра антибиотиков (1941-1960 гг.).
Открытие А. Флемингом, Х. Флори и Э. Чейном химиотерапевтической активности пенициллина стало важным этапом в развитии биотехнологии хозяйственно ценных веществ. Началась интенсивная работа по поиску активных продуцентов антибиотиков, получению мутантов с измененным наследственным материалом, обладающих способностью к сверхсинтезу, а также разработка методов культивирования грибов, создания технологических схем крупномасштабного производства.
Кроме того, существенную роль в эти годы сыграло использование клеток животных и растений. Например, культуры клеток человека при выращивании ряда вирусов для производства вакцин; при производстве высокоспецифических белков (антител и интерферонов); в исследованиях рака и в противовирусной химиотерапии. В 1943 г. С.Э. Лурия и М. Дельбрук определили наличие мутаций среди бактерий. Этот год является годом становления генетики бактерий, а впоследствии – развития генной инженерии. В этот период в СССР активно работают научные школы академиков Н.П. Дубинина, С.И. Алиханяна, И.А. Раппопорта, и др., исследующие вопросы генетики популяций, эволюционной, радиационной генетики, генетические основы селекции, различные аспекты химического мутагенеза. В 1953 г. Сенгер установил полную структуру белка инсулина, а Дж.Уотсон и Ф.Крик установили модель двойной спирали молекулы ДНК, был расшифрован механизм действия генетического аппарата. В 1957 г. А.Айсакс и И.Линдеман открыли интерферон. Широко используется культура растительной ткани: получение культуры из отдельных растительных клеток, обработка каллюса растительными гормонами. В 1958 г. молекула ДНК была впервые синтезирована в лаборатории. Эти открытия заложили фундамент молекулярной биологии и генной инженерии.
Эра управляемого биосинтеза (1961 – 1975 гг.).
Производство аминокислот посредством микробных мутантов является наиболее перспективным среди других способов их получения. Аминокислоты - это не только питательные вещества, но также ароматические и вкусовые агенты, и потому они широко используются в пищевой промышленности. Например, как питательную добавку в пищу чаще всего вносят лизин и метионин. Глутамат натрия и глицин употребляют как ароматические вещества для усиления и улучшения вкуса пищи. У глицина освежающий, сладкий вкус. Его вводят в сладкие напитки, и, кроме того, он проявляет там бактериостатическое действие. Цистеин предотвращает подгорание пищи, улучшает пекарские процессы и качество хлеба.
Производство микробного белка позволяет выпускать полноценные сбалансированные корма для выращивания птицы и скота. При этом микроорганизмы можно выращивать на различных питательных средах: на газах, нефти, отходах угольной, химической, пищевой, винно-водочной, деревообрабатывающей промышленности.
Не менее важным достижением биотехнологии в этот период было получение чистых ферментов, промышленное использование иммобилизованных ферментов и клеток. Впервые был получен биогаз, налажено производство полисахаридов, открыты ферменты рестриктазы и лигазы, позволяющие разрезать и сшивать молекулу ДНК в нужных местах.
Г) новейшая биотехнология
Этот этап стал возможным после эпохального открытия Д. Уотсона и Ф. Крика строения молекулы ДНК. Главными объектами исследований становятся живая клетка и молекула ДНК. Важнейшим достижением биотехнологии является генетическая трансформация, перенос чужеродных донорских генов в клетки-реципиенты микроорганизмов, растений и животных, получение трансгенных организмов с новыми или усиленными свойствами и признаками. В 1983 г. было получено первое генно-модифицированное растение – табак. В 1988 г. был разработан метод полимеразной цепной реакции (ПЦР). Работы с рекомбинантными молекулами ДНК позволили создать бактериальные штаммы-продуценты всех типов интерферонов, продуценты гормона роста человека и ряда животных, проинсулина человека и т.д. Не менее важное направление, сформировавшееся в эти годы, - получение гибридов, моноклональных антител, гибридов из протопластов и меристемных культур, трансплантация эмбрионов. Интенсивно развивается направление иммобилизации ферментов и клеток на специальных носителях, что обеспечивает их многократное использование.
В настоящее время в биотехнологии выделяют медико-фармацевтическое, продовольственное, сельскохозяйственное и экологическое направления. В соответствии с этим биотехнологию можно разделить на медицинскую, сельскохозяйственную, промышленную и экологическую.
Перспективы развития биотехнологии в различных отраслях:
- в промышленности (пищевая, фармацевтическая, химическая, нефтегазовая): использование биосинтеза и биотрансформации новых веществ на основе сконструированных методами генной инженерии штаммов бактерий и дрожжей с заданными свойствами;
- в сельском хозяйстве: разработка в области растениеводства трансгенных агрокультур, биологических средств защиты растений, бакудобрений и регуляторов роста, микробиологических методов рекультивирования почв; в области животноводства – получение вакцин и сывороток, создание эффективных кормовых препаратов из растительной, микробной биомассы и отходов сельского хозяйства, репродукция животных на основе эмбриогенетических методов;
- в медицине: разработка медицинских биопрепаратов, моноклональных антител, диагностикумов, вакцин, развитие иммунобиотехнологии;
- в экологии: разработка экологически безопасных технологий очистки сточных вод, утилизация отходов АПК, конструирование экосистем;
- в энергетике: применение новых источников биоэнергии, биоконверсия биомассы в биогаз и биотопливо.
ЛЕКЦИЯ 2
А)Классификации биотехнологий
генетическая инженерия
клеточная инженерия
клональное микроразмножение
микробиологический синтез
инженерная энзимология
Генетическая инженерия (генная инженерия) — совокупность приёмов, методов и технологий получения рекомбинантных РНК и ДНК, выделения генов из организма (клеток), осуществления манипуляций с генами и введения их в другие организмы.
Генетическая инженерия не является наукой в широком смысле, но является инструментом биотехнологии, используя методы таких биологических наук, как молекулярная и клеточная биология, цитология, генетика, микробиология, вирусология.
Клеточная инженерия - совокупность методов, используемых для конструирования новых клеток. Включает культивирование и клонирование клеток на специально подобранных средах, гибридизацию клеток, пересадку клеточных ядер и другие микрохирургические операции по «разборке» и «сборке» (реконструкции) жизнеспособных клеток из отдельных фрагментов.
Клональное микроразмножение - получение in vitro, неполовым путем, генетически идентичных исходному экземпляру растений. В основе метода лежит уникальная способность растительной клетки реализовывать присущую ей тотипотентность. Термин "клон" был предложен в 1903 году Уэбстером (от греческого klon - черенок или побег, пригодный для размножения растений).
Микробиологический синтез, промышленный способ получения химических соединений и продуктов (например, кормовых дрожжей), осуществляемый благодаря жизнедеятельности микробных клеток.
Инженерная энзимология, разрабатывает и осуществляет промышленные методы получения хим. веществ и продуктов (напр., пищевых), основанные на использовании в качестве катализаторов хим. реакций ферментов, выделенных обычно из биол. объектов или находящихся внутри клеток, которые искусственно лишены способности роста. инженерная энзимология - одно из направлений биотехнологии. Теоретические основы инженерной энзимологии - биоорганическая химия, биохимия, микробиология и химическая технология.
Б) Основные направления развития и области применения биотехнологии
Центральная проблема биотехнологии - интенсификация биопроцессов как за счет повышения потенциала биологических агентов и их систем, так и за счет усовершенствования оборудования, применения биокатализаторов (иммобилизованных ферментов и клеток) в промышленности, аналитической химии, медицине.
В основе промышленного использования достижений биологии лежит техника создания рекомбинантных молекул ДНК. Конструирование нужных генов позволяет управлять наследственностью и жизнедеятельностью животных, растений и микроорганизмов и создавать организмы с новыми свойствами. В частности, возможно управление процессом фиксации атмосферного азота и перенос соответствующих генов из клеток микроорганизмов в геном растительной клетки.
В качестве источников сырья для биотехнологии все большее значение будут приобретать воспроизводимые ресурсы не пищевых растительных материалов, отходов сельского хозяйства, которые служат дополнительным источником как кормовых веществ, так и вторичного топлива (биогаза), органических удобрений.
Одной из бурно развивающихся отраслей биотехнологии считается технология микробного синтеза ценных для человека веществ. По прогнозам, дальнейшее развитие этой отрасли повлечет за собой перераспределение ролей растениеводства и животноводства с одной стороны, и микробного синтеза - с другой, в формировании продовольственной базы человечества.
Не менее важным аспектом современной микробиологической технологии является изучения участия микроорганизмов в биосферных процессах и направленная регуляция их жизнедеятельности с целью решения проблемы охраны окружающей среды от техногенных, сельскохозяйственных и бытовых загрязнений.
Важным и перспективным направлением биотехнологии является разработка способов получения экологически чистой энергии. Получение биогаза и этанола были рассмотрены выше, но есть и принципиально новые экспериментальные подходы в этом направлении. Одним из них является получение фотоводорода. Если из хлоропластов выделить мембраны, содержащие фотосистему 2, то на свету происходит фотолиз воды - разложение на кислород и водород. Моделирование процессов фотосинтеза, происходящих в хлоропластах, позволило бы запасать энергию Солнца в ценном топливе - водороде.
Б) Рекомбинантные ДНК
Рекомбинантная ДНК — искусственно созданная человеком последовательность ДНК, части которой могут быть синтезированы химическим путём, с помощью ПЦР (полимеразная цепная реакция) или клонированы из ДНК различных организмов. Рекомбинантные ДНК могут быть трансформированы в клетки живых организмов в составе плазмид или вирусных векторов.
Под рекомбинантными понимают ДНК, образованные объединением in vitro (в пробирке) двух или более фрагментов ДНК, выделенных из различных биологических источников. Ключевыми в этом определении являются слова "фрагмент ДНК" и "объединение in vitro", что указывает на сущность генетической инженерии и ее отличие от всех остальных методов получения гибридных (или химерных) организмов, таких как генетическая селекция, эмбриональная инженерия и т.д.
Фрагменты ДНК, в том числе и фрагменты, содержащие гены, получают с использованием ферментов рестриктаз. Рестриктазы могут образовывать фрагменты как с тупыми, так и с липкими концами. Сшивка фрагментов ДНК производится тремя основными методами, зависящими от того, какие концы имеют фрагменты сшиваемых ДНК.
Сшивка по одноименным "липким" концам (рестриктазно лигазный метод)
Этот метод является самым распространенным и популярным. Впервые этим способом гибридная ДНК была получена С. Коэном с сотрудниками в 1973 году. Некоторые рестриктазы, например Pst I, внося в цепи ДНК симметричные, расположенные наискось друг от друга разрывы на равных расстояниях от центра сайта узнавания и образующие "ступеньку" (рис. 36). Эти комплементарные друг другу участки имеют тенденцию к ассоциации за счет спаривания оснований, и поэтому их называют комплементарными или липкими концами. Спаривание оснований происходит только между комплементарными последовательностями, поэтому ААТТ-концы, образуемые Eco RI, не будут спариваться, например, с АГЦТ-концами, образуемыми Hind III. Но любые два фрагмента (независимо от их происхождения), образовавшиеся под действием одной и той же рестриктазы, могут слипаться за счет образования водородных связей между однонитевыми участками комплементарных нуклеотидов
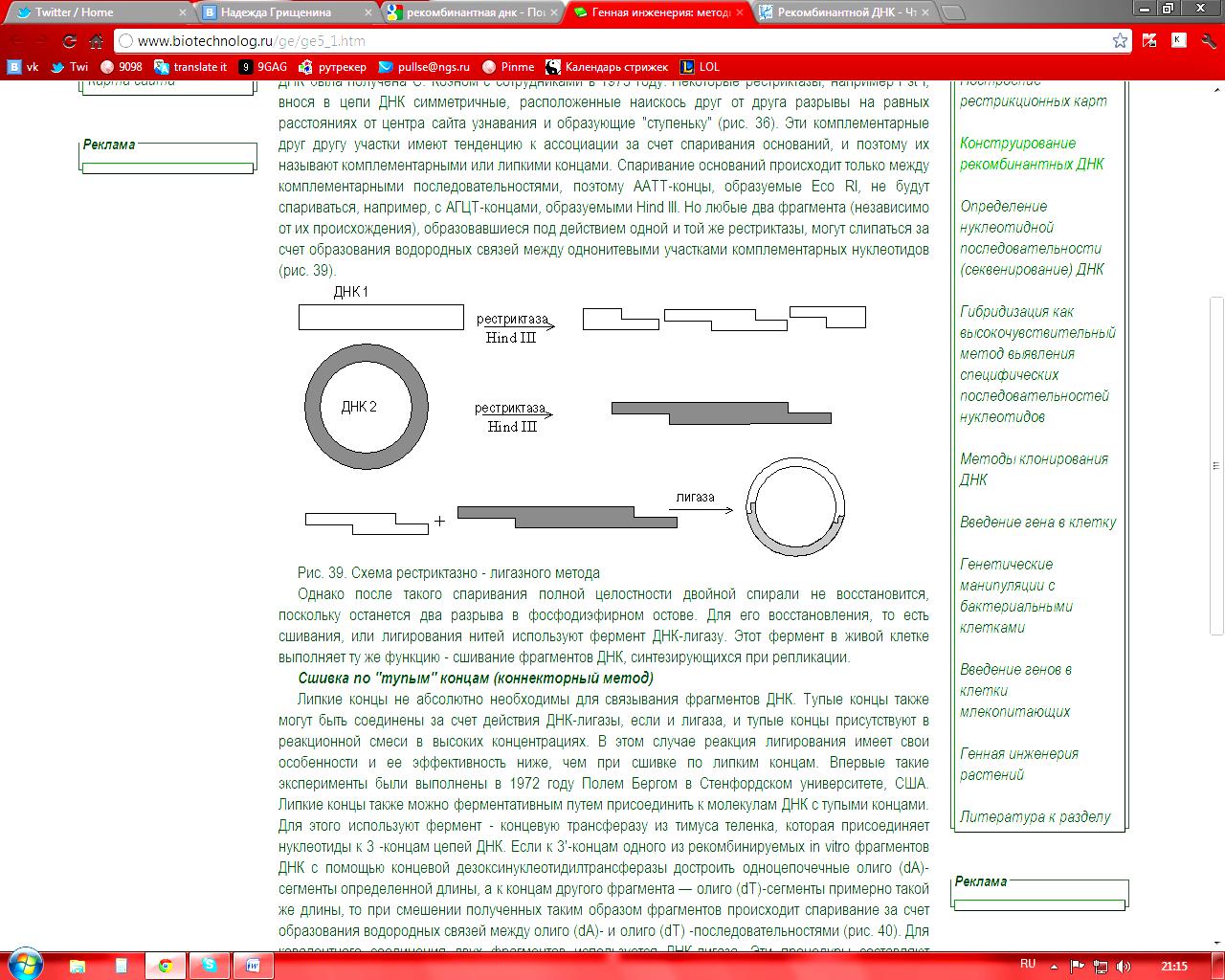
Однако после такого спаривания полной целостности двойной спирали не восстановится, поскольку останется два разрыва в фосфодиэфирном остове. Для его восстановления, то есть сшивания, или лигирования нитей используют фермент ДНК-лигазу. Этот фермент в живой клетке выполняет ту же функцию - сшивание фрагментов ДНК, синтезирующихся при репликации.
Сшивка по "тупым" концам (коннекторный метод)
Липкие концы не абсолютно необходимы для связывания фрагментов ДНК. Тупые концы также могут быть соединены за счет действия ДНК-лигазы, если и лигаза, и тупые концы присутствуют в реакционной смеси в высоких концентрациях. В этом случае реакция лигирования имеет свои особенности и ее эффективность ниже, чем при сшивке по липким концам. Впервые такие эксперименты были выполнены в 1972 году Полем Бергом в Стенфордском университете, США. Липкие концы также можно ферментативным путем присоединить к молекулам ДНК с тупыми концами. Для этого используют фермент - концевую трансферазу из тимуса теленка, которая присоединяет нуклеотиды к 3 -концам цепей ДНК. Если к 3'-концам одного из рекомбинируемых in vitro фрагментов ДНК с помощью концевой дезоксинуклеотидилтрансферазы достроить одноцепочечные олиго (dA)-сегменты определенной длины, а к концам другого фрагмента — олиго (dT)-сегменты примерно такой же длины, то при смешении полученных таким образом фрагментов происходит спаривание за счет образования водородных связей между олиго (dА)- и олигo (dT) -последовательностями (рис. 40). Для ковалентного соединения двух фрагментов используется ДНК-лигаза. Эти процедуры составляют основу для второго общего метода получения рекомбинантных молекул ДНК.
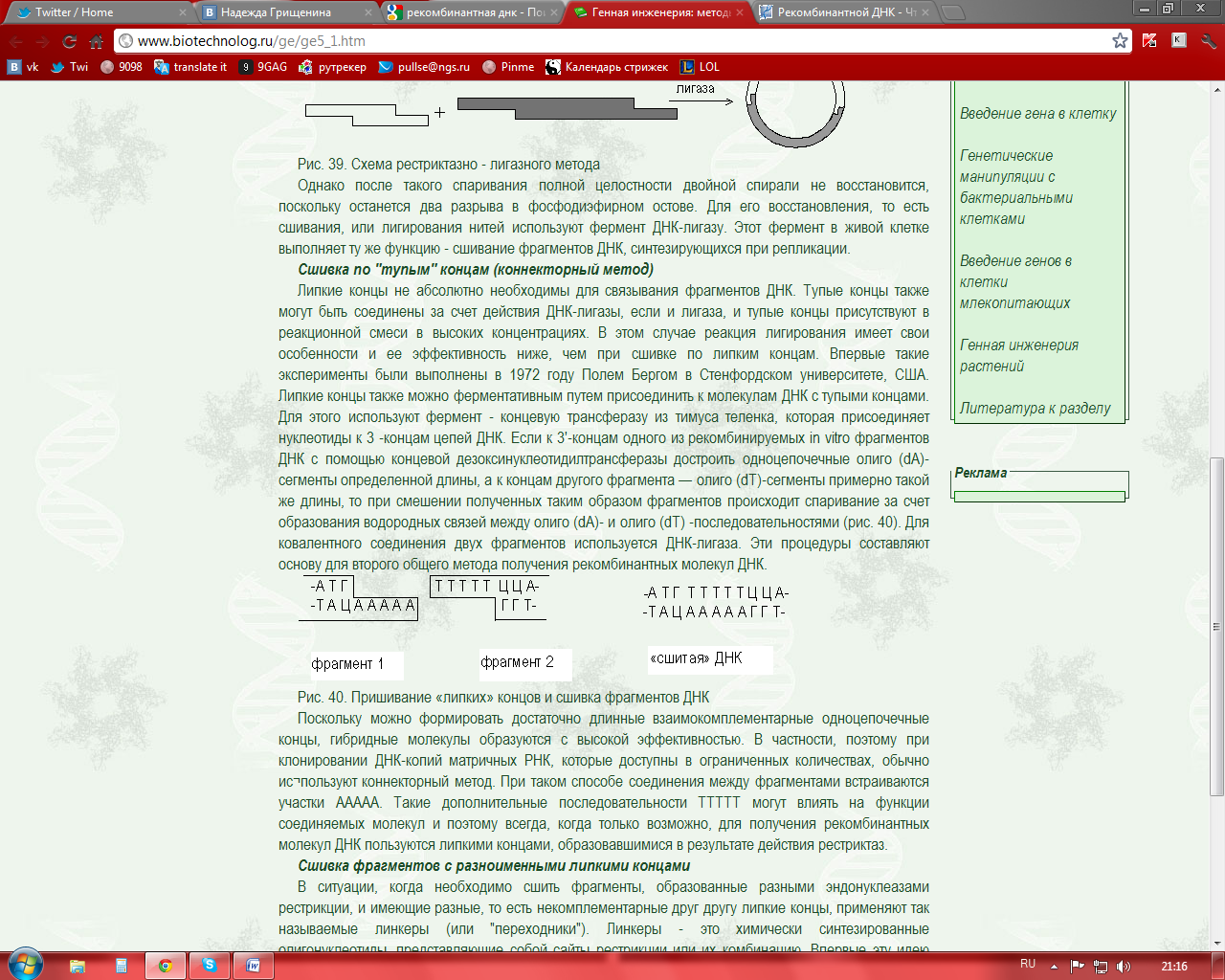
Поскольку можно формировать достаточно длинные взаимокомплементарные одноцепочечные концы, гибридные молекулы образуются с высокой эффективностью. В частности, поэтому при клонировании ДНК-копий матричных РНК, которые доступны в ограниченных количествах, обычно используют коннекторный метод. При таком способе соединения между фрагментами встраиваются участки ААААА. Такие дополнительные последовательности ТТТТТ могут влиять на функции соединяемых молекул и поэтому всегда, когда только возможно, для получения рекомбинантных молекул ДНК пользуются липкими концами, образовавшимися в результате действия рестриктаз.
Сшивка фрагментов с разноименными липкими концами
В ситуации, когда необходимо сшить фрагменты, образованные разными эндонуклеазами рестрикции, и имеющие разные, то есть некомплементарные друг другу липкие концы, применяют так называемые линкеры (или "переходники"). Линкеры - это химически синтезированные олигонуклеотиды, представляющие собой сайты рестрикции или их комбинацию. Впервые эту идею предложил Шеллер с сотрудниками в 1977 году.
Существуют большие наборы таких генных "переходников". Естественно, что при использовании линкеров должна учитываться необходимость соблюдения правил экспрессии генетической информации. Часто в середину линкера помещают какой-либо регуляторный генетический элемент, например, промотор или участок, связанный с рибосомой. В этом случае линкеры обеспечивают не только объединение генов, но и обуславливают их экспрессию. Существуют линкеры "тупой конец - липкий конец".
При необходимости липкие концы можно превратить в тупые. Это достигается либо отщеплением липких концов с помощью фермента - эндонуклеазы S1, которая разрушает только одноцепочечную ДНК, либо липкие концы "застраивают", то есть с помощью ДНК-полимеразы I на однонитевых липких концах синтезируют вторую нить.
В) Ферменты, используемые в генетической инженерии
Генетическая инженерия - потомок молекулярной генетики, но своим рождением обязана успехам генетической энзимологии и химии нуклеиновых кислот, так как инструментами молекулярного манипулирования являются ферменты. Если с клетками и клеточными органеллами мы подчас можем работать микроманипуляторами, то никакие, даже самые мелкие микрохирургические инструменты не помогут при работе с макромолекулами ДНК и РНК. Что же делать? В роли "скальпеля", "ножниц" и "ниток для сшивания" выступают ферменты.
Только они могут найти определенные последовательности нуклеотидов, "разрезать" там молекулу или, наоборот, "заштопать" дырку в цепи ДНК. Эти ферменты издавна работают в клетке, выполняя работы по репликации (удвоению) ДНК при делении клетки, репарации повреждений (восстановлению целостности молекулы), в процессах считывания и переноса генетической информации из клетки в клетку или в пределах клетки. Задача генного инженера - подобрать фермент, который выполнил бы поставленные задачи, то есть смог бы работать с определенным участком нуклеиновой кислоты.
Следует отметить, что ферменты, применяемые в генной инженерии, лишены видовой специфичности, поэтому экспериментатор может сочетать в единое целое фрагменты ДНК любого происхождения в избранной им последовательности. Это позволяет генной инженерии преодолевать установленные природой видовые барьеры и осуществлять межвидовое скрещивание.
Г) Ферменты, применяемые при конструировании рекомбинантных ДНК, можно разделить на несколько групп:
- ферменты, с помощью которых получают фрагменты ДНК (рестриктазы);
- ферменты, синтезирующие ДНК на матрице ДНК (полимеразы) или РНК (обратные транскриптазы);
- ферменты, соединяющие фрагменты ДНК (лигазы);
- ферменты, позволяющие осуществить изменение структуры концов фрагментов ДНК.
ЛЕКЦИЯ 3
А) Вектор — молекула нуклеиновой кислоты, чаще всего ДНК, используемая в генетической инженерии для передачи генетического материала другой клетке.
Существующие векторы:
плазмиды
фагмиды
векторы на основе вируса SV40
векторы на основе аденовирусов
векторы на основе герпесвирусов
векторы на основе ретровирусов
векторы на основе аденоассоциированного вируса
Б) трансгенные растения
Процесс получения трансгенных растений начинается с введения требуемых генов в недифференцированные клетки таким образом, чтобы они интегрировались в хромосомы. Введение чужеродных генов в клетки растений облегчается, если их клеточные стенки удаляют с помощью гидролитических ферментов - пектиназы и(или) целлюлазы, что приводит к образованию протопластов. Чужеродные гены, находящиеся в составе векторных плазмид, вводят в протопласты одним из стандартных способов с использованием эндоцитоза, стимулированного полиэтиленгликолем, электропорации, микроинъекций или бомбардировки микрочастицами, нагруженными векторной ДНК. После этого протопласты в течение нескольких дней культивируют на питательной среде для восстановления клеточных стенок и образующиеся клетки-трансфектанты используют для регенерации целых растений.
Основным направлением применения трансгеноза для генетической модификации культурных растений является повышение их устойчивости к неблагоприятным воздействиям окружающей среды, в частности вирусам и гербицидам.
Еще один подход к получению трансгенных растений, устойчивых к вирусам, основан на введении в них трансгенов, экспрессирующих в клетках моноклональные антитела, направленные против вирусных белков. С использованием такого метода создали эффективную систему защиты растений от вируса морщинистой мозаики артишока (AMCV) . Для этого сначала получили панель моноклональных антител к вирусу AMCV и отобрали гибридомы, продуцирующие антитела, которые взаимодействуют с консервативными участками белка оболочки вируса. Клетки гибридомы использовали для конструирования библиотеки кДНК, из которой выделили последовательности нуклеотидов, кодирующие полноразмерные тяжелые и легкие цепи иммуноглобулинов G класса 2b. С помощью ПЦР и универсальных праймеров амплифицировали вариабельные участки этих последовательностей (VH и VL), которые далее клонировали в экспрессирующем векторе E. coli, что сопровождалось образованием полипептидов VH и VL, соединенных линкерным пептидом (антитела scFV). После отбора клонов, продуцирующих высокоаффинные антитела к вирусному антигену (scFV), объединенные таким образом гены VH-VL помещали в экспрессирующий вектор и использовали для получения трансгенных растений табака Nicotiana bentamiana. Трансгенные растения содержали в своих клетках до 0.1% антител от суммарного белка и оказались устойчивыми к AMCV-инфекции, но не к вирусу мозаики цветной капусты (CMV), что указывало на специфический характер их резистентности.
В) Одним из важнейших достижений генной инженерии в практике животноводства является открытие соматотропного гормона (соматотропина или гормона роста). Но еще задолго до этого было известно, что экстракт гипофиза крупного рогатого скота стимулирует молочную продуктивность коров. Рассчитывали с помощью этого препарата быстро повысить надои животных. Но трудно было получать его в больших количествах и попробовали применить для этого метод генной инженерии. С помощью микробного синтеза на основе технологии рекомбинантных ДНК решили эту проблему.
Гормон роста берет участие в процессах стимуляции роста, деятельности молочной железы, влияет на обмен углеводов и липидов. Его инъецируют в составе генноинженерных гормонов, которые созданы для крупного рогатого скота, овец, свиней. Их клонирование осуществляют в клетках кишечной палочки и других микроорганизмов.
Использование этого гормона в скотоводстве при ежедневном введении (или через 2-3 дня) способствует повышению скорости роста молодняка на 10-15 %, удоя молока на 20-40 %. Состав молока при этом не меняется.
Положительные результаты получены в исследованиях по стимуляции с помощью соматотропина интенсивности роста свиней, овец, бычков, репродуктивных способностей свиней.
Г) Метод культуры изолированных тканей и клеток
Выделение клеток из тканейвысших растений и животных , и создание условий для роста и воспроизводства их in vitro.
Основные направления культивирования животных клеток
- культуры клеток;
- культуры органов и тканей (органные культуры).
Типы клеток, которые уже введены в культуру
элементы соединительной ткани человека (фибробласты),
скелетные ткани (кость и хрящи), скелетные,
сердечные и гладкие мышцы,
эпителиальные ткани (печень, легкие, почки и др.),
клетки нервной системы,
эндокринные клетки (надпочечники, гипофиз, клетки островков Лангерганса),
меланоциты и различные опухолевые клетки
Островки Лангерганса — скопления гормон-продуцирующих (эндокринных) клеток, преимущественно в хвосте поджелудочной железы
Меланоци́ты — специализированные клетки кожи, вырабатывающие пигмент меланин. У человека определяют конституционную меланиновую пигментацию (цвет кожи) и возможность загара.
Сферы применения культур растительных клеток
1. Получение биологически активных веществ растительного происхождения:
традиционных продуктов вторичного метаболизма (токсинов, гербицидов, регуляторов роста, алкалоидов, стероидов, терпеноидов, имеющих медицинское применение);
синтез новых необычных соединений, что возможно благодаря исходной неоднородности клеточной популяции, генетической изменчивости культивируемых клеток и селективному отбору клеточных линий со стойкими модификациями, а в некоторых случаях и направленному мутагенезу;
культивируемые в суспензии клетки могут применятся как мультиферментные системы, способные к широкому спектру биотрансформаций химических веществ (реакции окисления, восстановления, гидроксилирования, метилирования, деметилирования, гликолизирования, изомеризации).
В результате биотрансформации получают уникальные биологически активные продукты на основе синтетических соединений или веществ промежуточного обмена растений других видов.
2,Ускоренное клональное микроразмножение растений, позволяющее из одного экпланта получать от 10000 до 1000000 растений в год, причем все они будут генетически идентичны.
3. Получение безвирусных растений.
4. Эмбриокультура и оплодотворение in vitro часто применяются для преодоления постгамной несовместимости или щуплости зародыша, для получения растений после отдаленной гибридизации
5. Антерные культуры – культуры пыльников и пыльцы используются для получения гаплоидов и дигаплоидов.
6. Клеточный мутагенез и селекция. Тканевые культуры могут производить регенеранты, фенотипически и генотипически отличающиеся от исходного материала в результате сомаклонального варьирования. При этом в некоторых случаях можно обойтись без мутагенной обработки.
7. Криоконсервация и другие методы сохранения генофонда.
8. Иммобилизация растительных клеток.
9. Соматическая гибридизация на основе слияния растительных протопластов.
10.Конструирование клеток путем введения различных клеточных оганелл.
11.Генетическая трансформация на хромосомном и генном уровнях.
12. Изучение системы «хозяин – паразит» с использованием вирусов, бактерий, грибов и насекомых).
ЛЕКЦИЯ 4
А)Выращивание изолированных клеток, тканей, органов, растений-регенерантов, водных культур и грибов, используемых в биотехнологии, проводят в условиях полной асептики, т.е. стерильно. Особое внимание следует обратить на чистоту посуды, предназначенной для приготовления питательных сред и их компонентов; на подготовку объектов к пересадке, пассированию и культивированию. Только некоторые объекты (хлорелла, азолла) можно выращивать в нестерильных условиях.
Приемы и методы стерилизации
Стерилизация - полное уничтожение микроорганизмов и их покоящихся форм (например, спор). Существуют разные методы стерилизации: с помощью влажного пара, сухого пара, облучения ультрафиолетовыми лучами, обработки химическими веществами и микрофильтрации. Дробная стерилизация производится в аппарате Коха (другое название - обработка текучим паром). При его отсутствии можно 3 раза с интервалом в день по полчаса обрабатывать пробирки со средой паром в обычной пароварке. Такая процедура убивает вегетативные клетки бактерий, но не споры. Промежутки между стерилизацией необходимы для прорастания спор и повышения чувствительности к паровой обработке. Этот прием используют для стерилизации как питательных сред, так и посуды. Автоклавирование - обработка влажным паром под давлением, производится в автоклавах. Вегетативные клетки бактерий и грибов гибнут через 5-10 минут уже при температуре около 60оС; для гибели спор дрожжей и грибов требуется температура 120оС в течение 15 минут. Продолжительность автоклавирования зависит от величины (теплоемкости) пробирок, колб и объема питательной среды в них. Стерилизация посуды. Большинство культур в лабораторных условиях выращивают в пробирках, колбах Эрленмейера различного объема и чашках Петри одно- или многоразового использования. Вначале посуду тщательно моют с использованием детергентов, а также раствора двухромовокислого калия в серной кислоте (хромпика). Вымытую посуду ополаскивают водопроводной, затем дистиллированной водой и высушивают в сушильном шкафу. Чтобы избежать заражения стерильных предметов из воздуха, перед стерилизацией их закрывают ватными пробками, заворачивают в оберточную бумагу или закрывают фольгой (у стаканов, колб достаточно завернуть только горлышко). Затем посуду можно стерилизовать двумя способами:
Посуду выдерживают в автоклаве под давлением в течение 20-40 минут при температуре 100-130oС. Продолжительность автоклавирования зависит от его режима: при давлении 0.5 атмосферы - 20-40 минут, при 1 атм. - 15 минут.
При сухом способе стерилизации чашки Петри, колбы, стаканы, завернутые в плотную бумагу, стерилизуют в сушильном шкафу при температуре 140оС в течение 2 часов, при температуре 180оС - 30 минут. При более высоких температурах ватные пробки буреют, а бумага становится ломкой.
Стерилизация инструментов. Инструменты (скальпели, пинцеты, иглы и т.д.) стерилизуют в сушильном шкафу способом № 2. Шприцы, ножницы, пробочные сверла удобнее кипятить. Металлические предметы нельзя автоклавировать: под воздействием пара они ржавеют и тупятся. Непосредственно перед работой и в процессе её инструменты помещают в стакан со спиртом и обжигают в пламени спиртовки. Стерильный инструмент используют только для одноразовой манипуляции! Перед повторным употреблением его снова окунают в спирт и обжигают. Стерилизация материалов. Вату, марлю, ватные пробки, фильтровальную бумагу, халаты, косынки стерилизуют в автоклаве под давлением 2 атм. в течение 25-30 мин. Стерилизация питательных сред. Автоклавирование питательных сред для выращивания культур тканей проводят после их разлива в пробирки или колбы под давлением 0.7-0.8 атм. при температуре 115-120оС в течение 15 - 30 минут, в зависимости от объема среды. Если в результате стерилизации среда помутнела, следовательно, неправильно выбран режим стерилизации. Холодная стерилизация. Органические жидкости, не выносящие нагревания, освобождаются от бактерий при пропускании через стерильные мелкопористые бактериальные фильтры с диаметром пор 0.45 мкм.
Б) Среди веществ, синтезируемых растением, выделяют группу так называемых "вторичных метаболитов", то есть компонентов клетки, не являющихся необходимыми для ее выживания. К их числу относятся алкалоиды, гликозиды, стероиды, терпены, флавоноиды и другие вещества. Вторичные метаболиты нашли широкое применение в народном хозяйстве в качестве лекарственных средств , природных пестицидов , пищевых добавок , красителей и отдушек. Химический и микробиологический синтез ряда химических соединений не всегда дает положительные результаты в сравнении с получением их из растительного сырья. Новые возможности для производства вторичных метаболитов открывает культивирование растительных клеток in vitro. Установлено, что в культуре клеток in vitro способность к синтезу вторичных метаболитов сохраняется. Преимущество этого способа в сравнении с традиционным получением из растительного сырья заключается в независимости от погодных условий, высоком выходе и качестве продукции, возможности организации промышленного производства. Конечным критерием в таком случае является рентабельность производства химических соединений. Для культивирования суспензионной культуры с целью производства вторичных метаболитов используют закрытые или открытые системы в периодическом или проточном режимах. В закрытой системе при периодическом режиме выращивания, клеточная масса остается закрытой в определенном объеме среды до конца выращивания. В закрытой непрерывной культуре в систему периодически подается свежая питательная среда, а старая удаляется в том же объеме. Клетки при этом остаются в системе в течение всего цикла выращивания. В открытые проточные культуры периодически ( или непрерывно) поступает свежая питательная среда, однако отбирается не только старая среда, но и часть урожая клеточной массы. Наиболее изученным и распространенным режимом культивирования клеточных суспензий является закрытая периодическая система. В этом случае для аэрации и перемешивания используют роллеры, качалки , ферментеры, где аэрация осуществляется механическими мешалками или воздушным потоком. Для промышленного выращивания суспензионной культуры растений служат ферменты, которые обеспечивают стерильность условий культивирования, регулирование факторов среды (температура, газовый состав, освещенность и др.) на различных этапах развития суспензионной культуры и возможность контролировать путем отбора проб продуктивность биомассы и синтез вторичных метаболитов. Деление клеток, приводящее к увеличению клеточной биомассы, и синтез вторичных метаболитов разобщены во времени. Синтез вторичных метаболитов возрастает в фазе замедленного роста клеточной популяции и достигает максимума в стационарной фазе. Для получения вторичных метаболитов возможно культивирование не только суспензионных клеток, но и каллуса на твердой питательной среде ( например, каллуса женьшеня и других лекарственных растений). Технология производства биомассы женьшеня из каллуса освоена на Бобруйском гидролизном заводе.
В) Разработка методов культивирования in vitro различных видов растений создала предпосылки для применения принципиально новых подходов к их размножению. В настоящее время для ряда культур разработаны технологии клонального микроразмножения, т.е. способа вегетативного размножения растений на основе культуры in vitro. Такие технологии особенно актуальны для культур, размножаемых в производстве преимущественно вегетативно (картофель, плодовые, ягодные, декоративные, лесные растения).При длительном вегетативном размножении традиционными способами (черенки, луковицы, усы и т.д.) дочерние растения накапливают вирусную, бактериальную и грибную инфекцию, что снижает качество посадочного материала. Возникает необходимость в оздоровлении посадочного материала от инфекции. Перед клональным микроразмножением стоят следующие цели: 1. Ускоренное размножение уникальных генотипов в селекции растений; 2. Промышленное размножение посадочного материала высоких репродукций в семеноводстве растений; 3. Оздоровление посадочного материала от вирусной , бактериальной и грибной инфекции в процессе размножения; 4. Поддержание неконстантного материала, расщепляющегося в процессе семенного размножения (гибриды плодовых, ягодных, декоративных, и др. культур) 5. Размножение культур с длительным жизненным целом (древесные растения). 6. Размножение растений, которые невозможно или трудно размножить in vivo (стерильные формы для гетерозисной селекции). Преимущества клонального микроразмножения в сравнении с традиционными методами заключаются в следующем: 1. Метод обеспечивает высокий коэффициент размножения , что дает возможность быстро внедрить в производство новые сорта растений. Метод не имеет альтернативы для видов,не размножаемых или трудноразмножаемых in vivо; 2. В процессе размножения обеспечивается оздоровление посадочного материала путем применения методов апикальных меристем, термотерапии или химиотерапии; 3. Небольшое количество стартового материала, возможность его сохранения в генбанках, в т.ч. in vitro; 4. Выполнение работ в лабораторных условиях независимо от условий внешней среды, экономия площадей, возможность регуляции средовых факторов; 5. Возможность автоматизации выращивания in vitro, применения промышленных технологий получения посадочного материала. К недостаткам метода клонального микроразмножения следует отнести сложность и высокую цену применяемого оборудования, возможность повышения частоты мутаций в культуре in vitro, удорожание посадочного материала. В связи с этим клональное микроразмножение целесообразно применять для получения высоких репродукций в семеноводстве с последующим применением традиционных методов вегетативного размножения оздоровленного посадочного материала.
Г) Изолированные протопласты представляют собой клетки, лишенные оболочки. Оболочка растительных клеток состоит главным образом из целлюлозы, гемицеллюлозы и пектиновых веществ. Для ее разрушения применяют ферментативные смеси на основе целлюлаз, гемицеллюлаз и пектиназ. Впервые изолирование протопластов из клеток высших растений с использованием ферментов было осуществлено Е. Кокингом. В настоящее время технология получения протопластов отработана для ряда культурных растений: табак, перец, баклажан, картофель, томаты, соя, клевер люцерна морковь, рапс и др.
Растительные протопласты способны восстанавливать клеточную оболочку, в результате делений образовывать каллус и в результате регенерации формировать растения. Благодаря этой способности протопласты нашли широкое применение в биотехнологии при гибридизации соматических клеток, переносе субклеточных частиц, клеточной селекции и генетической инженерии
Получение протопластов, таким образом, позволяет переходить с организменного уровня на клеточный и обратно, манипулировать содержанием растительной клетки, изменяя ее генетический аппарат. Исходным материалом для выделения протопластов могут быть различные части растений- листья, корни, семядоли, гипокотили, пыльцевые зерна, каллусные и суспензионные культуры. Оптимальные условия для выделения протопластов индивидуальны для различных растений и типов тканей. Главными факторами являются состав ферментов, рН среды, выбор осмотического раствора, физиологическое состояние, возраст и условия выращивания исходного растения. Вероятность получения жизнеспособных протопластов увеличивается, если растения находятся в состоянии активного роста.
ЛЕКЦИЯ 5
A) ИНЖЕНЕРНАЯ ЭНЗИМОЛОГИЯ, разрабатывает и осуществляет пром. методы получения хим. в-в и продуктов (напр., пищевых), основанные на использовании в качестве катализаторов хим. р-ций ферментов, выделенных обычно из биол. объектов или находящихся внутри клеток, к-рые искусственно лишены способности роста.
И. э. - одно из направлений биотехнологии. Теоретич. основы И. э. - биоорг. химия, биохимия, микробиология и хим. технология.
Широкое применение ферментов в орг. синтезе стало возможным благодаря использованию иммобилизованных ферментов, а также иммобилизов. клеток микроорганизмов (использование в пром-сти последних иногда относят к др. направлению биотехнологии - микробиологическому синтезу). Иммобилизация придает ферментам качества гетерог. катализаторов, что позволяет удалять их из реакц. смеси (отделять от субстратов и продуктов ферментативных р-ций) простой фильтрацией.
Фементы (энзимы) - это белки, выполняющие роль катализаторов в живых организмах. Основные функции ферментов - ускорять превращение веществ, поступающих в организм и образующихся при метаболизме (для обновления клеточных структур, для обеспечения его энергией и др.), а также регулировать биохимические процессы (напр., реализацию генетической информации), в т.ч. в ответ на изменяющиеся условия.
ИММОБИЛИЗОВАННЫЕ ФЕРМЕНТЫ (от лат. immobiiis - неподвижный), препараты ферментов, молекулы к-рых связаны с матрицей, или носителем (как правило, полимером), сохраняя при этом полностью или частично свои каталитич. св-ва. Иммобилизованные ферменты обычно не раств. в воде; между двумя фазами возможен обмен молекулами субстрата, продуктов каталитич. р-ции, ингибиторов и активаторов.
В последнее время получило достаточно широкое распространение применение иммобилизованных клеток микроорганизмов, содержащих естественный набор ферментов.
Преимущество иммобилизованных клеток по сравнению с иммобилизованными ферментами заключается в том, что при их использовании:
отпадают стадии выделения, очистки и иммобилизации ферментов, которые обходятся производству значительно дороже в осуществлении полного технологического процесса. Ферменты в микроорганизме находятся в своем естественном окружении (они термостабильны, работают более длительно, сохраняют свои каталитические свойства достаточно долго, они не уступают иммобилизованным ферментам в свойствах гетерогенных биокатализаторов).
Иммобилизация целых клеток микроорганизмов проводится аналогично иммобилизации ферментов, предотвращая их размножение, увеличивая сохранность и срок работы в качестве катализатора по сравнению с необработанными клетками.
Носители – это вещества органической и неорганической природы.
Органические: желатин, фибрин, альгинат натрия, целлюлоза, карбоксиметилцеллюлоза, ПААГ-полиакриламидный гель.
Неорганические – термический песок, активированный уголь, окись алюминия, бентонит.
Источники ферментов – природные объекты, в которых содержание фермента составляет не менее 1%.
Все основные источники ферментов можно разделить на три основные группы:
1. Ткани животных как отход мясоперерабатывающей промышленности. Прежде всего, это богатые ферментами поджелудочная железа и слизистая оболочка желудка.
2. Некоторые растения. Например, такие гидролитические ферменты, как папаин и рицин извлекают соответственно из сока дынного дерева и инжирного дерева, из ячменя - амилазу.
Иммобилизация – физическое разделение биообъекта (клетка, фермент) и растворителя, то есть биообъект закреплен на нерастворимом носителе, а субстрат и продукты свободно обмениваются между биообъектом и растворителем.
Биообъект может работать в этом случае многократно (неделя, месяц).
Другими словами можно сказать, что иммобилизация ферментов – это перевод их в нерастворимое состояние с сохранением ( частичным или полным) каталитической активности.
Применение ферментов: Ферменты сохраняют свои уникальные свойства (эффективность, специфичность действия) вне клеток. В отличие от химических катализаторов, ферменты нетоксичны, функционируют в мягких условиях, используют доступное сырье (в том числе и отходы), в связи с чем их применение в промышленности выгодно с экономической и экологической точек зрения. По объему производства ферменты занимают третье место после аминокислот и антибиотиков и находят все более широкое применение в текстильной, кожевенной, целлюлозно-бумажной, медицинской, химической промышленности. Ферменты разных классов используют для разрушения и модификации антропогенных органических соединений, поступающих в окружающую среду. Ферменты применяются в медицине. Так, протеолитические ферменты (амилаза, липаза) используются при заболеваниях желудочно-кишечного тракта, печени и поджелудочной железы. В последние годы показана эффективность применения протеиназ в лечении злокачественных новообразований. Протеолитические ферменты (плазмин и др.) используются для растворения тромбов в кровеносных сосудах. Коллагеназа применяется для рассасывания рубцовых образований, а эластаза – для задержки развития атеросклероза. Ферменты используются в диагностических целях, например, для выявления инфаркта миокарда или заболеваний печени.
Б) ИММОБИЛИЗОВАННЫЕ ФЕРМЕНТЫ (от лат. immobiiis - неподвижный), препараты ферментов, молекулы к-рых связаны с матрицей, или носителем (как правило, полимером), сохраняя при этом полностью или частично свои каталитич. св-ва. Иммобилизованные ферменты обычно не раств. в воде; между двумя фазами возможен обмен молекулами субстрата, продуктов каталитич. р-ции, ингибиторов и активаторов.
Коммерческое использование ферментов ограничено рядом факторов. Важнейшие из них - нестабильность ферментов и их высокая стоимость. Стоимость можно существенно снизить за счет иммобилизации фермента. Это означает, что фермент закрепляют на поверхности или внутри твердой подложки, которую легко удаляют из реакционной смеси после завершения ферментации. Фермент может быть использован повторно, что существенно снижает стоимость процесса.
Другое преимущество иммобилизации заключается в том, что фермент становится более стабильным, вероятно, за счет ограничения его способности денатурировать при изменениях рН, температуры и растворителей. К примеру, иммобилизованная глюкозоизомераза стабильна при 65°С в течение года, тогда как в растворе она денатурирует при 45 °С за несколько часов.
Иммобилизованный фермент можно использовать для непрерывного (открытого) производства, пропуская реагенты через фермент и собирая продукт на конечном этапе.
Преимущества иммобилизованных ферментов перед нативными предшественниками:
1. Гетерогенный катализатор легко отделим от реакционной среды, что дает возможность остановить реакцию в любой момент, использовать фермент повторно, а также получать чистый от фермента продукт.
2. Ферментативный процесс с использованием иммобилизованных ферментов можно проводить непрерывно, регулируя скорость катализируемой реакции и выход продукта.
3. Модификация фермента целенаправленно изменяет его свойства, такие как специфичность (особенно в отношении макромолекулярного субстрата), зависимость каталитической активности от рН, ионного состава и других параметров среды, стабильность к денатурирующим воздействиям.
4. Можно регулировать каталитическую активность иммобилизованных ферментов путем изменения свойств носителя действием физических факторов, таких как свет и звук. Иммобилизовать ферменты можно как путем связывания на нерастворимых носителях, так и путем внутримолекулярной или межмолекулярной сшивки белковых молекул низкомолекулярными бифункциональными соединениями, а также путем присоединения к растворимому полимеру.
Методы иммобилизации ферментов
Существуют различные способы иммобилизации ферментов. Они включают либо механическое включение (захват) фермента, либо его присоединение к определенной структуре, или матрице. Преимуществом метода захвата является то, что фермент сохраняется в естественном состоянии. Однако крупным молекулам трудно добраться до фермента.
Физическая иммобилизация ферментов представляет собой включение фермента в такую среду, в которой для него доступной является лишь ограниченная часть общего объема. При физической иммобилизации фермент не связан с носителем ковалентными связями. Существует четыре типа связывания ферментов:
Для получения иммобилизованных ферментов обычно применяют
следующие методы:
1. Ковалентное присоединение молекул ферментов к водонерастворимому
носителю, в качестве которого используют как органические (природные и
синтетические) полимеры, так и неорганические материалы. К природным
материалам относятся целлюлоза, хитин, агароза, декстраны, бумага,
ткани, полистирол, ионообменные смолы и так далее.
2. Захват фермента в сетку геля или полимера.
3. Ковалентная сшивка (сшивание) молекул фермента друг с другом или с
инертными белками при помощи би- или полифункционального реагента.
4. Адсорбция фермента на водонерастворимых носителях (часто на ионитах)
5. Микрокапсулирование (захват раствора фермента в полупроницаемые
капсулы размером 5-300 миллимикрон).
Существуют различные способы иммобилизации ферментов. Они включают либо механическое включение (захват) фермента, либо его присоединение к определенной структуре, или матрице. Преимуществом метода захвата является то, что фермент сохраняется в естественном состоянии. Однако крупным молекулам трудно добраться до фермента.
Физическая иммобилизация ферментов представляет собой включение фермента в такую среду, в которой для него доступной является лишь ограниченная часть общего объема. При физической иммобилизации фермент не связан с носителем ковалентными связями. Существует четыре типа связывания ферментов:
Для иммобилизации ферментов в геле существует два основных способа. При одном из них фермент помещают в водный раствор мономера, а затем проводят полимеризацию, в результате чего образуется полимерный гель с включенными в него молекулами фермента. В реакционную смесь часто добавляют также бифункциональные (содержащие в молекуле две двойные связи) сшивающие агенты, которые придают образующемуся полимеру структуру трехмерной сетки. В другом случае фермент вносят в раствор готового полимера, который затем каким-либо образом переводят в гелеобразное состояние. Способ иммобилизации ферментов путем включения в полимерный гель позволяет создавать препараты любой геометрической конфигурации, обеспечивая при этом равномерное распределение биокатализатора в объеме носителя. Метод универсален, применим для иммобилизации практически любых ферментов, полиферментных систем, клеточных фрагментов и клеток. Фермент, включенный в гель, стабилен, надежно защищен от инактивации вследствие бактериального заражения, так как крупные клетки бактерий не могут проникнуть в мелкопористую полимерную матрицу. В то же время, эта матрица может создавать значительные препятствия для диффузии субстрата к ферменту, снижая каталитическую эффективность иммобилизованного препарата, поэтому для высокомолекулярных субстратов данный метод иммобилизации не применим вообще.
Захват шариками альгината легко продемонстрировать на лабораторных занятиях; он является наиболее распространенным промышленным методом. Раствор, содержащий фермент и альгинат натрия, по каплям вносят в раствор хлористого кальция. Как только капельки вступают в контакт с хлористым натрием, они немедленно начинают превращаться в гель; при этом образуются идеальные по форме шарики геля, содержащие внутри захваченный фермент. Для длительного использования гель можно стабилизировать полиакриламидом или приготовить его в виде пластин, если поместить его на тканевую основу.
Главным отличительным признаком химических методов иммобилизации является то, что путем химического взаимодействия на структуру фермента в его молекуле создаются новые ковалентные связи, в частности между белком и носителем. Препараты иммобилизованных ферментов, полученные с применением химических методов, обладают по крайней мере двумя важными достоинствами. Во-первых, ковалентная связь фермента с носителем обеспечивает высокую прочность образующегося конъюгата. При широком варьировании таких условий, как рН и температура, фермент не десорбируется с носителя и не загрязняет целевых продуктов катализируемой им реакции. Это особенно важно при реализации процессов медицинского и пищевого назначения, а также для обеспечения устойчивых, воспроизводимых результатов в аналитических системах. Во-вторых, химическая модификация ферментов способна приводить к существенным изменениям их свойств, таких как субстратная специфичность, каталитическая активность и стабильность.
