- •Экзаменационный билет № 13
- •Ковалентная химическая связь. Полярная и неполярная ковалентная связь. Простые и кратные связи в неорганических веществах.
- •2. Предельные одноосновные карбоновые кислоты, их строение и свойства на примере уксусной кислоты.
- •Физические свойства
- •Химические свойства Реакции кислот, обусловленные карбоксильной группой
- •Получение кислот
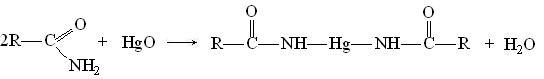
- •Особенности свойств муравьиной кислоты
- •Сложноэфирная конденсация
Физические свойства
Низшие кислоты (муравьиная, уксусная, пропионовая) – бесцветные остропахнущие жидкости, кислоты с числом атомов углерода от 4 до 9 – маслянистые жидкости с неприятным запахом, с числом атомов углерода больше 10 – твердые вещества. Растворимость кислот в воде резко уменьшается по мере увеличения числа атомов углерода в молекуле. Температуры кипения кислот возрастают по мере увеличения молекулярной массы, при этом температуры кипения кислот, содержащих одинаковое число атомов углерода и имеющих неразветвленный радикал, выше, чем у кислот с разветвленным радикалом. Кислоты кипят при значительно более высоких температурах, чем соответствующие им спирты. Это связано со значительно большей ассоциацией молекул кислот.
Химические свойства Реакции кислот, обусловленные карбоксильной группой
Перераспределение электронной плотности в карбоксильной группе показано на рисунке:
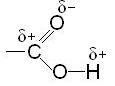
В результате полярность связи О-Н настолько велика, что сравнительно легко протекает диссоциация кислоты:
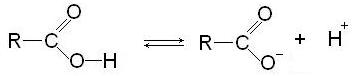
Образующийся анион обладает повышенной стабильностью за счет резонанса:
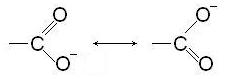
Сила карбоновых кислот зависит от радикала, связанного с карбоксильной группой и определяется величиной положительного заряда на карбоксильном углероде. С увеличением этого заряда сила кислоты возрастает, с уменьшением – убывает. В свою очередь, величина этого заряда определяется знаками эффектов (индуктивного и мезомерного), действующих со стороны радикала. Так как положительный индуктивный эффект углеводородного радикала увеличивается с увеличением числа атомов углерода и с увеличением разветвленности радикала, сила соответствующих карбоновых кислот убывает. Муравьиная кислота относится к кислотам средней силы, все остальные одноосновные предельные кислоты – слабые. Растворимые в воде кислоты создают в растворе кислую среду, достаточную для изменения окраски индикаторов.
1. Карбоновые кислоты взаимодействуют с металлами, оксидами и гидроксидами металлов, образуя соли:
2CH3COOH + Zn = (CH3COO)2Zn + H2
2CH3COOH + CaO = (CH3COO)2Ca + H2O
CH3COOH + NaOH = CH3COONa + H2O
Карбоновые кислоты сильнее угольной кислоты, поэтому они способны разлагать карбонаты:
CH3COOH + Na2CO3 = CH3COONa + CO2 + H2O
2. При действии на карбоновые кислоты галогенидов фосфора или хлористого тионила гидроксил карбоксильной группы замещается на галоген и образуются галогенангидриды кислот:

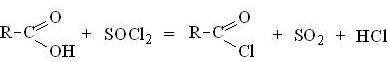
3. Со спиртами карбоновые кислоты вступают в реакцию этерификации, в результате которой образуются сложные эфиры. Реакция протекает обратимо в кислой среде. Катализатором этерификации служат минеральные кислоты, например, серная. На первой стадии реакции протонируется кислород карбоксильной группы:
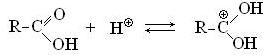
Затем образовавшийся катион подвергается нуклеофильной атаке молекулой спирта:
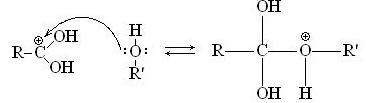
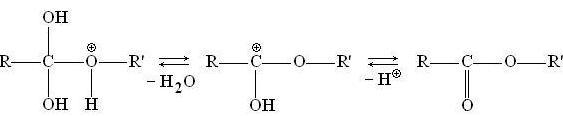
Промежуточный комплекс может обратимо терять молекулу воды и протон, превращаясь в результате в сложный эфир:
В щелочной среде сложный эфир необратимо гидролизуется с образованием спирта и соли исходной кислоты. Эта реакция называется омылением сложного эфира.
4. Карбоновые кислоты образуют функциональные производные, к которым относятся галогенангидриды, сложные эфиры, ангидриды, амиды и нитрилы кислот. Ангидриды, амиды и нитрилы непосредственно из кислот чаще всего получить невозможно, поэтому используют косвенные методы.
Ангидриды кислот получают нагреванием галогенангидрида и натриевой соли кислоты, например:
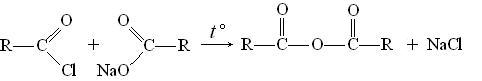
Амиды образуются при обработке галогенангидридов кислот аммиаком:
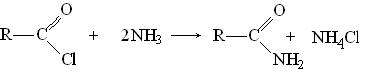
при сухой перегонке (нагревании) аммониевых солей карбоновых кислот:
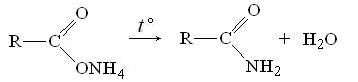
или при неполном гидролизе нитрилов кислот:
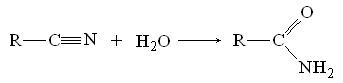
Нитрилы получаются в результате нуклеофильного замещения атома галогена цианогруппой:
![]()
или при обезвоживании амида кислоты оксидом фосфора (V) при нагревании:

Большинство реакций с участием функциональных производных карбоновых кислот протекает по механизму нуклеофильного замещения SN1 и SN2, в котором функциональные производные являются субстратами. Например, в разбавленных водных растворах гидролиз хлорангидридов кислот проходит преимущественно по механизму SN1, на первой, самой медленной стадии которого (именно эта стадия и определяет скорость всего процесса) происходит диссоциация исходного хлорангидрида:
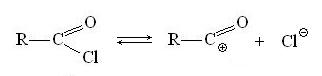
На второй стадии следует быстрая нуклеофильная атака молекулы воды на карбоксильный углерод, и после ухода протона образуется конечный продукт гидролиза - карбоновая кислота:
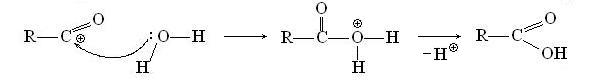
При бимолекулярном замещении SN2 нуклеофильная атака и уход иона хлора происходят одновременно:
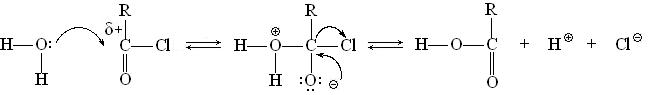
Бимолекулярный механизм преобладает при низком содержании воды в реакционной системе. Ниже приведены некоторые реакции нуклеофильного замещения в функциональных производных кислот.
Галогенангидриды кислот разлагаются водой (гидролиз):
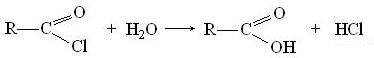
реагируют со спиртами с образованием сложных эфиров (алкоголиз):
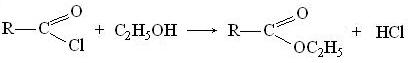
Сложные эфиры получаются и при взаимодействии галогенангидридов с алкоголятами:
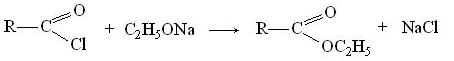
В результате взаимодействия галогенангидридов с солями карбоновых кислот образуются ангидриды, таким путем можно получить и смешанные ангидриды, содержащие остатки разных кислот:
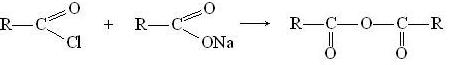
При действии на галогенангидриды кислот аммиака (аммонолиз) образуются амиды:
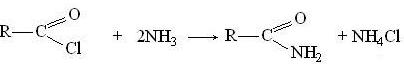
Под действием пероксидов галогенангидриды кислот образуют перекиси ацилов:
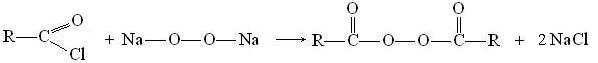
Ангидриды кислот при нагревании с водой гидролизуются:
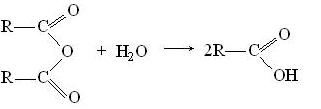
подвергаются алкоголизу при нагревании со спиртом, при этом образуется сложный эфир и кислота:
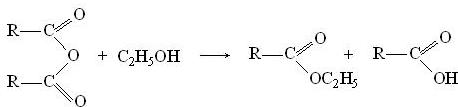
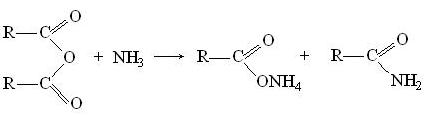
Под действием аммиака происходит аммонолиз ангидрида, в результате получается амид и соль кислоты:
Амиды кислот гидролизуются при кипячении с водными растворами кислот и щелочей:
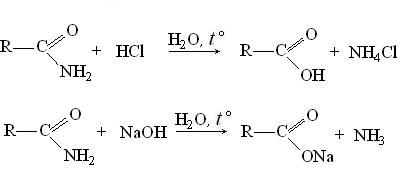
Атом водорода в аминогруппе амида может замещаться металлом, например: