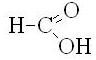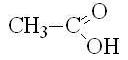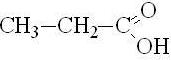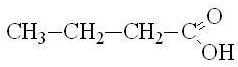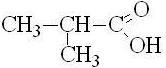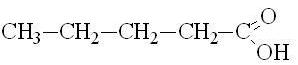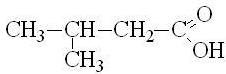- •Экзаменационный билет № 13
- •Ковалентная химическая связь. Полярная и неполярная ковалентная связь. Простые и кратные связи в неорганических веществах.
- •2. Предельные одноосновные карбоновые кислоты, их строение и свойства на примере уксусной кислоты.
- •Физические свойства
- •Химические свойства Реакции кислот, обусловленные карбоксильной группой
- •Получение кислот
- •Особенности свойств муравьиной кислоты
- •Сложноэфирная конденсация
Экзаменационный билет № 13
Ковалентная химическая связь. Полярная и неполярная ковалентная связь. Простые и кратные связи в неорганических веществах.
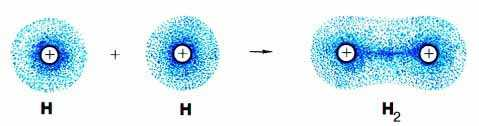
Химическую связь между атомами, возникающую путем обобществления электронов с образованием общих электронных пар, называют ковалентной. При сближении двух атомов, имеющих неспаренные электроны, происходит взаимное проникновение соответствующих электронных орбиталей, их перекрывание. В месте перекрывания образуется так называемая электронная плотность, т.е. область пространства, где вероятность нахождения электрона значительно увеличивается. Область перекрывания условно считают общей электронной парой двух атомов. Ковалентную связь, образующуюся между атомами с одинаковой электроотрицательностью, называют неполярной. Ковалентная неполярная связь – связь между атомами с одинаковой ЭО, когда общие электронные пары находятся на одинаковом расстоянии от обоих взаимодействующих атомов и в равной степени принадлежат им обоим.
Электроотрицательность (ЭО) - это способность атомов химического элемента притягивать к себе общие электронные пары в соединении.
В молекуле Н2 оба атома водорода имеют одинаковую электроотрицательность, следовательно, обладание электронной парой для них одинаково. Такую химическую связь называют неполярной, так как у каждого атома хлора электронная плотность одинакова, и общая пара электронов в равной степени принадлежит обоим атомам.
Ковалентная полярная связь – связь между атомами с незначительно различающейся электроотрицательностью, когда общие электронные пары смещены в сторону более ЭО химического элемента. Ковалентная полярная связь образуется между атомами неметаллов с разной электроотрицательностью.
В молекуле хлороводорода HCL химическая связь полярная, так как электронная плотность на атоме хлора ( элемента с большей электроотрицательностью ) значительно выше, чем на атоме водорода. Происходит наложение их электронных оболочек, образование зоны повышенной электронной плотности и обобществление электронов. Но общая пара электронов смещается в сторону более электроотрицательного элемента хлора. Формируются частичные заряды. Ковалентные связи классифицируют не только по полярности связи и механизму образования общих электронных пар, но и по числу общих электронных пар. Атомы способны образовывать также две или три общие электронные пары, например в молекулах азота или оксида углерода (IV).
Ковалентная связь характеризуется насыщаемостью. отличие от ионной и металлической связи, для ковалентной можно точно определить, какие именно атомы связаны друг с другом, как они взаимно расположены в пространстве. Следовательно, ковалентная связь обладает направленностью. Вещества с ковалентным типом связи в твердом состоянии образуют кристаллические решетки двух типов: атомные и молекулярные.
2. Предельные одноосновные карбоновые кислоты, их строение и свойства на примере уксусной кислоты.
Одноосновные предельные карбоновые кислоты (одноосновные насыщенные карбоновые кислоты) – карбоновые кислоты, в которых насыщенный углеводородный радикал соединен с одной карбоксильной группой -COOH. Все они имеют общую формулу СnH2n+1COOH, где n = 0, 1, 2, ...
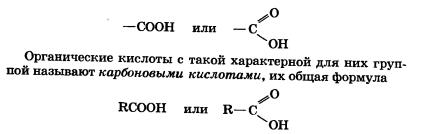
Изомерия предельных одноосновных карбоновых кислот обусловлена только изомерией углеводородного радикала. Формулы и названия некоторых кислот приведены в таблице:
Предельные карбоновые кислоты |
||
ФОРМУЛА |
Название |
|
Тривиальное |
по ИЮПАК |
|
|
муравьиная |
метановая |
|
уксусная |
этановая |
|
пропионовая |
пропановая |
|
масляная |
бутановая |
|
изомасляная, диметилуксусная |
бутановая |
|
валериановая |
пентановая |
|
изовалериановая |
3-метилбутановая |
|
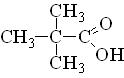
триметилуксусная |
2,2-диметилпропановая |