
- •Открытые системы. Синергетика как новое научное направление Элементы нелинейной неравновесной термодинамики
- •Второе начало термодинамики
- •Понятие о синергетике
- •Условия возникновения новых стационарных состояний в диссипативных структурах:
- •Почему из хаоса возникают сложные, упорядоченные системы?
- •Рассмотрим несколько примеров самоорганизации, чтобы понять, о чем идет речь.
- •4. Динамика популяций хищников и их жертв – самоорганизация в биологии.
- •Обратные связи
- •Циклы Кондратьева
- •Самоорганизация в экономике
- •Самоорганизация как основа эволюции экономических систем
- •Критические состояния. Бифуркации.
Открытые системы. Синергетика как новое научное направление Элементы нелинейной неравновесной термодинамики
В этом разделе физики рассматриваются в основном открытые системы.
Открытая система обменивается с окружающей средой энергией, массой, информацией.
Термодинамическая система – емкость с идеальным газом. Такая система характеризуется макро- и микропараметрами.
Макропараметры характеризуют систему в целом; нельзя отнести к отдельному элементу давление (P), и температуру (T).
Микропараметры характеризуют отдельные элементы системы (например m0 – масса; vi – скорость; Ei – энергия отдельных молекул).
Система может находиться в равновесном или неравновесном состояниях.
Равновесное состояние – состояние системы, когда все макропараметры во всех точках одинаковы. При этом состоянии ее элементы находятся в непрерывном хаотическом движении.
Неравновесное состояние – состояние, когда в одной или нескольких областях системы макропараметры отличаются от макропараметров других областей. При этом в неравновесной системе возможно возникновение направленного кооперативного действия множества элементов системы.
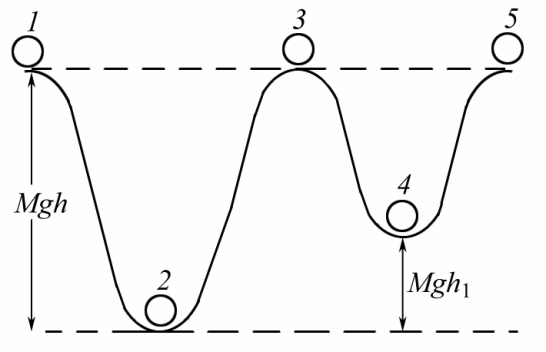
1, 3, 5 – неустойчивые положения; 2, 4 – устойчивые положения
Состояние системы называется стационарным, если ее параметры не изменяются с течением времени.
Равновесие называется устойчивым, если при небольшом отклонении системы от положения равновесия, возникают силы, возвращающие систему в равновесное положение.
Устойчивое положение равновесия соответствует минимуму потенциальной энергии.
Равновесие называется неустойчивым, если при отклонении системы от этого состояния возникают силы, увеличивающие это отклонение.
Всеобщий принцип для всех систем: всякая система стремится к минимуму потенциальной энергии (устойчивое состояние равновесия).
Равновесным называется процесс, в результате которого система переходит в новое состояние через ряд последовательных равновесных состояний.
В природе медленно протекающие процессы могут рассматриваться как равновесные.
Все равновесные процессы являются обратимыми.
При обратимом процессе термодинамическая система возвращается в исходное состояние так, что в окружающей ее среде не остается никаких изменений.
Круговой процесс (ряд процессов), в результате которого система возвращается в исходное состояние называется циклом.
Как цикл, так и процесс может быть прямым и обратным.
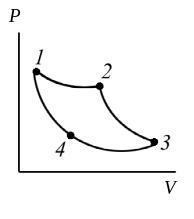
Цикл Карно (обратимый цикл):
Если процесс протекает по часовой стрелке (1, 2, 3, 4), то цикл – прямой, если против (4, 3, 2, 1) – обратный, который состоит из тех же процессов, протекающих в обратном порядке (см. рисунок).
Отличие обратимого и обратного циклов состоит в том, что при обратном цикле не накладывается запрет на изменения в окружающей среде.
К обратимым процессам могут быть отнесены (с некоторым приближением) все механические явления, которые протекают с очень малым трением (колебания маятника, подпрыгивание упругого мяча и т.д.).
Примерами необратимых процессов являются процессы переноса – в них возникают элементы самоорганизации – направленного кооперативного действия множества элементов системы.
Процессы переноса (необратимые):
1. Диффузия – перенос массы или концентрации вещества. Возникает, если в одной области системы большее давление или концентрация, чем в другой. Перенос происходит из мест более высокого давления или концентрации в места менее высокого давления или концентрации.
2. Внутреннее трение – перенос импульса. Возникает при движении двух соприкасающихся слоев жидкости или газа с разными скоростями. При этом слой жидкости или газа, который движется с большей скоростью – тормозится, а с меньшей скоростью – ускоряется. Между слоями жидкости возникает трение.
3. Теплопроводность – перенос тепла или энергии. Возникает при разных температурах в разных областях системы.
Характеристики всех трех видов переноса:
возникают при неравновесном состоянии системы;
наряду с хаотическим движением существует направленное движение множества элементов системы;
все процессы переноса заканчиваются, если система переходит в равновесное состояние. Следовательно, процессы переноса переводят систему в равновесное состояние;
все процессы переноса являются необратимыми.
Выводы. Если закрытая система предоставлена самой себе, то она обязательно придет в равновесное состояние благодаря явлениям переноса и будет оставаться в таком положении до тех пор, пока внешняя среда не выведет эту систему из положения равновесия. Поэтому состояние равновесия является наиболее вероятным состоянием системы неживой природы. (Закрытая система всегда придет в состояние равновесия).
Состояние равновесия является симметричным. Этому состоянию соответствует беспорядок.

Состояние равновесия, беспорядок, симметричное состояние |
|
Направленное движение молекул, порядок, асимметричное состояние |
При возникновении направленного движения молекул возникает упорядоченное состояние.
Тому и другому состоянию соответствует величина, которая его характеризует.
Беспорядок характеризуется энтропией (S) – характеристика беспорядка. Понятие энтропии ввел Клаузиус в 1854 году.
Характеристика порядка – негэнтропия (введена Э. Шредингером).
Если энтропия возросла, то в такой системе увеличился беспорядок. И наоборот.
В обществе, где увеличивается порядок, энтропия должна убывать, а негэнтропия расти.
