
Уравнение Шредингера:
![]() ,
,
где - волновая функция электрона, U – потенциальная энергия, Е – полная энергия, x, y, z – координаты.
2dV- вероятность пребывания электрона в объеме dV.
Решение уравнения Шредингера в большинстве случаев представляет сложную математическую задачу.
Одним из основных положений квантовой механики является соотношение неопределенностей, установленное Гейзенбергом: невозможно одновременно точно определить местоположение частицы и ее количество движения – импульс p =mv. Чем точнее определяется координата частицы «X», тем более неопределенным становится ее импульс «P» и наоборот. Соотношение неопределенностей имеет вид:
![]()
Учитывая, что mV = p – импульс или количество движения электрона, получаем:
![]() ,
,
где ΔX, ΔV и ΔP – неопределенности соответственно в положении, скорости и импульсе частицы.
Таким образом появилось представление о том, что электроны в атоме не движутся по определенным орбитам, а как бы размазаны в пространстве вокруг ядра по всему объему атома, образуя электронное облако переменной плотности. Плотность электронного облака пропорциональна квадрату волновой функции. Около ядра существует область, в которой нахождение электрона наиболее вероятно.
Область пространства вокруг атомного ядра, в которой наиболее вероятно пребывание электрона, называется орбиталью.
Квантовомеханическое рассмотрение различных случаев движения микрочастиц в ограниченной области пространства (например, в атоме, молекуле и т.д.) показывает, что волновая функция частицы всегда содержит безразмерные параметры, которые могут принимать ряд целочисленных значений. Эти величины называются квантовыми числами. Они определяют функцию радиального распределения вероятности пребывания электрона в атоме.
Графики этих функций показаны на рисунках:
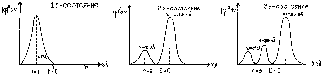
Состояние электрона в атоме согласно квантово-механическим представлениям можно описать с помощью чисел, называемых квантовыми. Они могут принимать только определенные значения. Эти числа следующие:
n – главное квантовое число, l – орбитальное квантовое число,
m – магнитное квантовое число, s – спиновое квантовое число.
В таблице даны пределы изменений численных и соответствующих им буквенных обозначений, а также характеристики квантовых чисел.
|
Таблица Квантовые числа, пределы изменений и характеристика |
||||
|
Обозначение |
Пределы изменения и обозначения |
Число значений |
Характеристика |
|
|
Главное n |
1, 2, 3, 4, 5,…, ∞ K L M N O |
∞ |
Энергетический уровень (энергия и номер уровня). Удаленность от ядра. |
|
|
Побочное (орбитальное) l |
|
0, 1, 2, 3, …..(n – 1) s p d f
|
n |
Орбитальный момент количества движения электрона. Подуровень энергетического уровня. Энергия и форма орбитали. |
|
Магнитное m |
-l,…, 0…,+l |
2l+1 |
Орбитальный магнитный момент электрона. Ориентация орбитали в пространстве. |
|
|
s |
±1/2 |
2 |
Собственный момент количества движения электрона. |
|
Энергетические состояния электрона в атоме строго квантованы, они называются разрешенными.
Рассмотрим соотношение главного и орбитального квантовых чисел:
n (уровни) |
1 |
2 |
3 |
||||
l (подуровни) |
цифровые |
0 |
0 |
1 |
0 |
1 |
2 |
буквенные |
s |
s |
p |
s |
p |
d |
|
Обозначения подуровней |
1s |
2s |
2p |
3s |
3p |
3d |
|
Количество подуровней на уровне |
1 |
2 |
3 |
||||
Из соотношения n и l следует, что количество подуровней на уровне равно номеру уровня.
Далее рассмотрим соотношение орбитального и магнитного квантовых чисел:
l (подуровень) |
0(s) |
1(p) |
2 (d) |
|
||||||||||||
m ) |
0 |
- 1 |
0 |
+1 |
- 2 |
- 1 |
0 |
+1 |
+2 |
|
||||||
Количество способов ориентации (квантовых ячеек) (2l +1) |
1 |
3 |
5 |
|
||||||||||||
Обозначения способов ориентации |
|
px |
py |
pz |
dxy |
dxz |
dyz |
dx2-y2 |
dz2 |
|||||||
Обозначения квантовых ячеек |
|
|
|
|
||||||||||||
Из соотношения орбитального и магнитного квантовых чисел следует, что l подуровню соответствует (2l +1) способов ориентации, т.е. квантовых ячеек. s- орбиталь может быть ориентирована только одним способом, р- орбиталь – тремя (по координатным осям), а d-орбиталь- пятью и т.д.(рис.)

Рис. Формы s-, p- и d- орбиталей и способы их ориентации в пространстве
Каждая тройка чисел (n, l и m) определяет орбиталь.
Например, 2рx-орбиталь, Зdz2-орбиталь. Обозначение орбитали: цифра показывает энергетический уровень, т.е. n; буква – тип подуровня (обозначение энергетического подуровня) и подстрочный индекс обозначает ориентацию орбитали относительно выбранного направления, задаваемую магнитным квантовым числом. Термин "орбиталь", таким образом, одновременно определяет и энергию электрона, и характерную форму пространственного распределения электронного облака. Наиболее распространенный способ изображения орбитали заключается в графическом представлении граничной поверхности, охватывающей некоторую существенную долю, например, 90% электронной плотности орбитали. Для s–орбиталей такие контурные изображения имеют форму сфер, для р–форму гантелей. Формы орбиталей для различных энергетических состояний электрона в атомах представлены на рисунке.
Набор орбиталей с одинаковым значением главного квантового числа n определяет энергетический уровень (иногда применяется термин "электронная оболочка").
Совокупность орбиталей с одинаковыми значениями l образует энергетический подуровень, например, третий энергетический уровень имеет три подуровня: 3s, 3p и 3d. Число энергетических подуровней равно числу значений l.
Номер периода в таблице Д.И.Менделеева соответствует максимальному значению n и определяет количество энергетических уровней в атоме.
Для обозначения орбитали можно воспользоваться ячеистой моделью, в которой каждой орбитали соответствует клеточка (квантовая ячейка). Число клеточек на подуровне равно числу значений магнитного квантового числа, т.е. числу орбиталей. Таким образом, квантовая ячейка – состояние электрона с одинаковыми значениями главного, орбитального и магнитного квантовых чисел.
В
данной модели каждый электрон обозначается
стрелкой, которая может быть
направлена вверх
![]() или вниз
или вниз
![]() ,
что соответствует двум значениям
спинового квантового числа.
,
что соответствует двум значениям
спинового квантового числа.
