
Строение электронных оболочек атомов
К началу XX столетия было установлено, что атом является сложной системой, состоящей из положительно заряженного ядра и движущихся электронов. Предпосылкой этого послужило:
─открытие катодных и β− лучей, представляющих собой поток отрицательно заряженных частиц ( электронов) (1897г. Дж.Дж.Томсон),
─определение массы (9.1·10-28г., что составляет 1/1897 часть массы атома водорода) и заряда (1,6·10-19к.) электрона,
─открытие и изучение явления радиоактивности (1896г. Беккерель,. Мария Кюри - Складовская, Пьер Кюри),
─открытие α- лучей, представляющих собой поток положительно - заряженных частиц с массой равной 4 углеродным единицам и величиной заряда равной удвоенному заряду электрона (ядра атома гелия Не2+),
─опыты Столетова, установившие корпускулярно-волновую двойственность фотона.
В 1903году Дж. Томсон предложил первую теорию строения атома, которая получила название «булка с изюмом». Смыслом ее было предположение, что электроны, как изюм в тесте распределены между положительно заряженными частицами. Эта теория не была подтверждена экспериментальным доказательством.
Э.Резерфорд в 1911году предложил ядерную теорию строения атома. Согласно этой теории в центре атома находится положительно заряженное ядро, вокруг которого вращаются электроны. В целом атом электронейтрален, т.к. суммарный заряд электронов численно равен заряду ядра. Поскольку масса электрона ничтожно мала, практически вся масса атома сосредоточена в его ядре. Объем, занимаемый ядрами, составляет примерно 10-13 от общего объема атомов, т.е. плотность атомных ядер очень велика. Эта теория была основана на результатах экспериментов по изучению явления рассеяния α – частиц при прохождении их через металлическую фольгу. Теория Резерфорда получила широкое распространение и получила название «планетарной», однако она не могла объяснить ни устойчивости атома, ни линейчатого характера спектров.
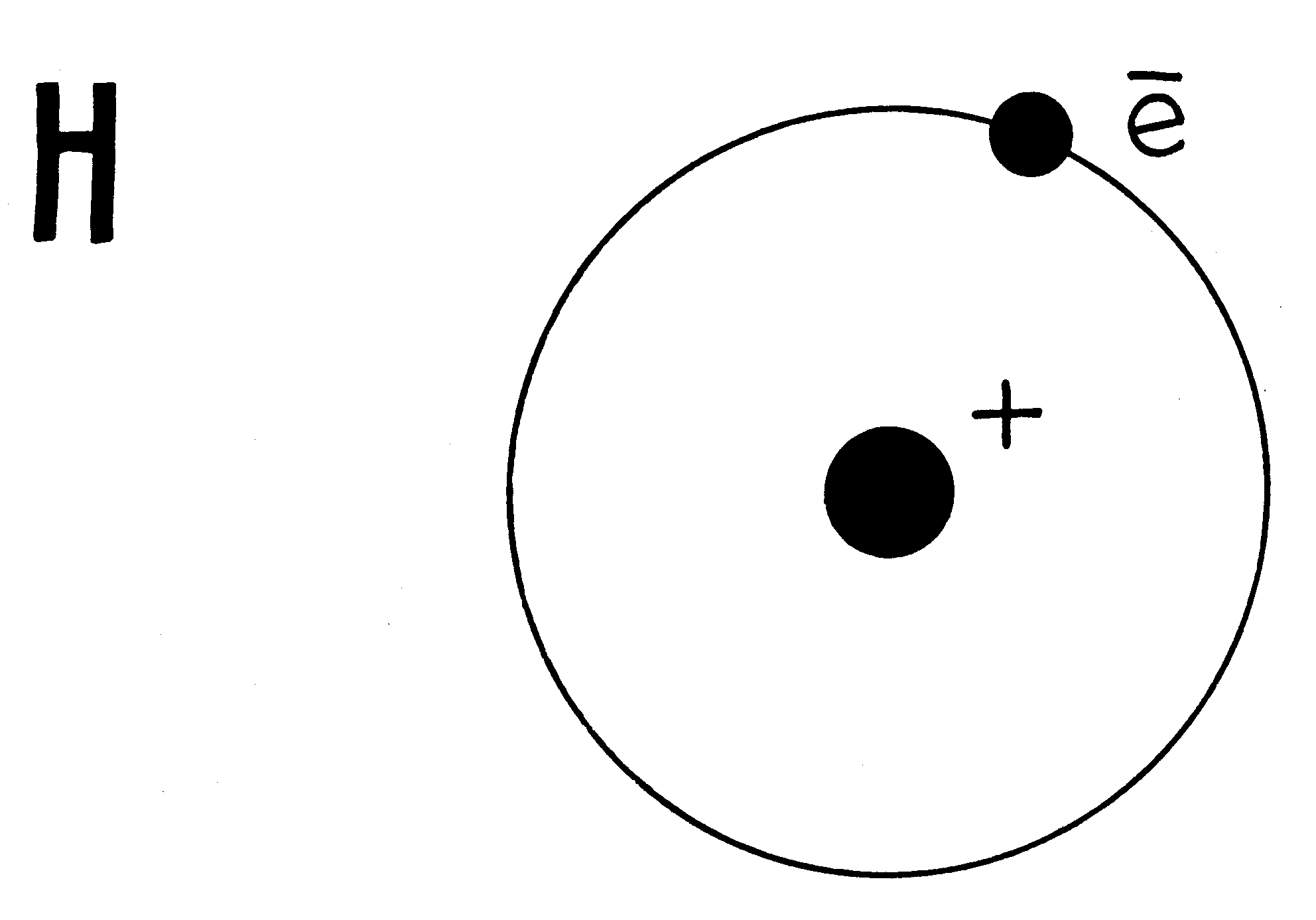
Радиус атома водорода 10-8см
В 1913 году датский физик Нильс Бор на основе квантовой теории излучения Планка развил теорию строения атома. Он предложил три постулата, основным из которых является предположение о существовании неких стационарных (дозволенных) орбит, двигаясь по которым электрон не излучает энергию. Излучение и поглощение энергии происходит только при переходе электрона с одной орбиты на другую. Каждому переходу соответствует определенная порция (квант) энергии и определенная частота излучения. Бор на основе своей теории удачно согласовал ядерную модель с линейчатым спектром водорода. Однако оставалось неясной природа «стационарной орбиты».
В 1924 году было положено начало созданию современной квантово-механической теории строения атома. Французский физик Луи Де-Бройль постулировал корпускулярно-волновую двойственность электрона, т.е. он предположил, что электрон так же, как и фотон, обладает как свойствами частицы (имеет массу), так и свойствами волны (характеризуется длиной волны или частотой излучения). Используя следующие преобразования, он вывел уравнение
E = mc2
= mc2
mc2 = h
E = h
![]()
![]() ;
;
![]()
согласно которому частица, имеющая массу m, движущаяся со скоростью υ, характеризуется длиной волны λ.
Предположение Луи Де Бройля о наличии у электрона волновых свойств было экспериментально подтверждено уже в 1927 году (К.Д. Девиссон и Л.Х. Джермер в США, Дж.П.Томсон в Англии и П.С.Тарковский в СССР) – было установлено, что электроны обладают свойствами дифракции и интерференции. В настоящее время волновые свойства электронов широко используются в электронографии – методе изучения структуры веществ, основанном на дифракции электронов.
Представление о волновых свойствах электрона позволяет определить смысл «стационарной» орбиты Бора – это орбита, на которой длина волны электрона укладывается целое число раз:

Исходя из представления о волновых свойствах электрона, австрийский физик Эрвин Шредингер в 1925 году предположил, что состояние движущегося в атоме электрона должно описываться известным уравнением стоячей электромагнитной волны:
![]()
где - амплитуда волны; - длина волны; x, y, z – координаты.
Подставив в это уравнение вместо длины волны ее выражение из уравнения Де Бройля, он получил уравнение, связывающее энергию электрона с пространственными координатами и волновой функцией ψ, соответствующей в этом уравнении амплитуде трехмерного волнового процесса. Волновая функция ψ может принимать как положительные так и отрицательные значения. Однако величина ψ2 всегда положительна. При этом, чем больше ψ2 в данной области пространства, тем выше вероятность пребывания там электрона. Более точно вероятность обнаружения электрона в некотором малом объеме ΔV выражается произведением ψ2 ΔV.
