
- •Химическая термодинамика
- •Часть 1
- •Термохимия
- •Цель работы
- •Теоретическая часть
- •Экспериментальная часть
- •Порядок выполнения работы
- •Обработка результатов эксперимента
- •Расчет теплоты образования твердого раствора kCl . RBr
- •Определение изменения температуры в калориметрическом опыте
- •Расчет теплоты образования кристаллогидрата
- •Контрольные вопросы
- •II. Изучение равновесия гомогенной реакции в растворе
- •Цель работы
- •Теоретическая часть
- •Экспериментальная часть
- •Порядок выполнения работы
- •Обработка экспериментальных данных
- •Контрольные вопросы
- •III. Определение коэффициента распределения иода между органическим и неорганическим растворителями
- •Цель работы
- •Теоретическая часть
- •Экспериментальная часть
- •3.2. Порядок выполнения работы
- •Обработка результатов эксперимента
- •Контрольные вопросы
- •IV. Изучение взаимной растворимости в трехкомпонентных системах
- •Цель работы
- •Теоретическая часть
- •Экспериментальная часть
- •Порядок выполнения работы
- •Обработка экспериментальных данных
- •Контрольные вопросы
- •Литература
- •Содержание
- •Термохимия
Обработка результатов эксперимента
Рассчитать концентрацию иода в водном слое:
С1
=
![]() .
.
По каждой колбе рассчитывают результаты 3 параллельных опытов, берется средний результат и заносится в таблицу.
Рассчитать концентрацию иода в неводном слое:
С2
=
![]()
Расчет ведется аналогично водному слою, результаты заносятся в
таблицу 7.
Рассчитать значения С1, С2 по каждому опыту и построить график в координатах ln C1 = f(lnC2) в соответствии с уравнением:
lnK = n ln C2 – lnC1
ln C2
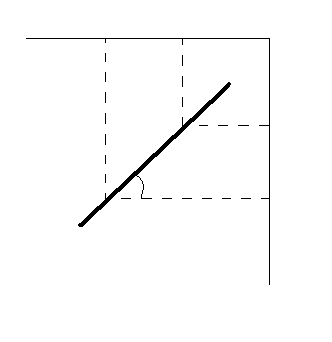 ln C2”
ln C2’
ln C2”
ln C2’
ln C1’
ln C1”
ln C1
Рассчитать показатель степени n в уравнении (19) по графику:
N
= tg
α
=
![]()
4.5. Рассчитать
значение коэффициента распределения
для четырех опытов: К = С![]()
4.6. Рассчитать среднее значение коэффициента распределения:
Кср = (К1 + К2 + К3 + К4)/4.
4.7. Сформулировать выводы, сравнить полученный результат со справочными данными [7] и оформить отчет.
Контрольные вопросы
Каково термодинамическое условие самопроизвольного образования истинного раствора при постоянных Р и Т?
Что называется активностью компонента раствора?
Водный 0,02 М раствор пикриновой кислоты находится в равновесии с 0,07 М раствором пикриновой кислоты в бензоле. Вычислить коэффициент распределения пикриновой кислоты между бензолом и водой, если в бензольном растворе пикриновая кислота имеет нормальную молярную массу, а в воде частично диссоциирована, причем степень диссоциации равна α = 0,9
При распределении уксусной кислоты между тетрахлоридом углерода и водой были получены следующие концентрации (моль/л):
в тетрахлориде углерода……………3,63 7,25
в воде………………………………...54,20 76,40
Уксусная кислота в воде имеет нормальную молярную массу. Определить молярную массу уксусной кислоты в растворе ССl4 и коэффициент распределения.
IV. Изучение взаимной растворимости в трехкомпонентных системах
Цель работы
Формирование навыков экспериментального изучения фазового равновесия в трехкомпонентных системах с ограниченной растворимостью жидкостей, построение изотермических диаграмм растворимости и анализа этих диаграмм.
Теоретическая часть
В трехкомпонентных системах существует большое число вариантов взаимной растворимости. Рассмотрим некоторые из них, наиболее характерные и часто встречающиеся на практике.
1. Любые два из трех компонентов системы смешиваются друг с другом во всех соотношениях. В тройных системах жидкости также смешиваются во всех соотношениях (например, в системе «вода – спирт этиловый – ацетон») или в тройных смесях в некоторой области концентраций наблюдается расслоение системы на две фазы (например, в системе «вода – фенол – ацетон» при 67 – 900С).
2. Два компонента (А и С) ограниченно растворимы друг в друге, а остальные две пары компонентов (А-В и В-С) обнаруживают неограниченную взаимную растворимость (например, в системе «вода – хлороформ – уксусная кислота»).
3. Два компонента (А и С) неограниченно растворимы друг в друге, а остальные две пары компонентов (А-В и В-С) обнаруживают ограниченную взаимную растворимость ( например, в системе «анилин – фенол – вода»). Добавление третьего компонента в двухфазной двухкомпонентной системе увеличивает взаимную растворимость и приводит к образованию однофазной системы, или добавление третьего компонента к двухфазной системе почти не увеличивает взаимной растворимости (или уменьшает ее). Возможен непрерывный переход от двухфазной смеси компонентов А и В к двухфазной смеси компонентов В и С.
4. Для всех трех пар компонентов (А – В, В – С, А – С) наблюдается ограниченная взаимная растворимость (например, в системе «вода – анилин – гексан»). Добавление к двухфазной системе третьего компонента резко увеличивает взаимную растворимость двух компонентов и приводит к образованию однофазной системы, или добавление к двухфазной системе третьего компонента существенно не увеличивает взаимной растворимости и может привести к образованию трехфазной системы.
5. Все три компонента совершенно не растворимы друг в друге ( например, в системе «вода – ртуть – бензол).
Отнести данную систему к тому или иному типу можно лишь с учетом условий (например, температуры), при которых она рассматривается. Изменение температуры влияет на взаимную растворимость жидкостей и иногда столь значительно, что может изменить даже тип диаграммы
( изотерма взаимной растворимости).
Состав трехкомпонентной системы изображается на диаграмме, представляющей правильный треугольник. Вершины равностороннего треугольника соответствуют чистым веществам А, В и С. На сторонах, соединяющих вершины, откладываются составы двухкомпонентных систем, образованных веществами, находящимися в прилегающих вершинах треугольника. Все точки, расположенные внутри треугольника, выражают составы трехкомпонентных систем. Процентное содержание каждого из компонентов в системе тем больше, чем ближе расположена данная точка к соответствующей вершине.
Существует два метода определения состава трехкомпонентной системы. В методе, предложенном Гиббсом, за 100% (или единицу) принимается высота правильного треугольника. Метод основан на том, что сумма длин перпендикуляров, опущенных из любой точки внутри правильного треугольника на его стороны, есть величина постоянная и равная высоте этого треугольника. Процентное содержание каждого компонента определяется расстоянием от точки Р, отражающей состав системы, до стороны треугольника, противолежащей вершине, соответствующей чистому компоненту (рис. 5). Отрезок Ра соответствует процентному содержанию компонента А, отрезок Рb – процентному содержанию компонента В, отрезок Рс - процентному содержанию компонента С.
Для определения состава трехкомпонентной системы пользуются также свойствами треугольника Гиббса:
а) отрезок, проведенный внутри треугольника из его вершины к противоположной стороне, является геометрическим местом точек с постоянным соотношением содержания компонентов, лежащих на остальных вершинах;
б) отрезок, проведенный внутри треугольника параллельно одной из сторон, является геометрическим местом точек с постоянным содержанием компонента, лежащего на противоположной вершине.
По методу Розебома за 100% ( или единицу) принимается длина стороны правильного треугольника. Из данной точки Р на выбранную сторону (например АВ) проводят отрезки, параллельные двум другим сторонам треугольника (АС и ВС): PD и РЕ. Отрезок AD соответствует процентному содержанию компонента В, отрезок ЕВ соответствует процентному содержанию компонента А, отрезок DE соответствует процентному содержанию компонента С. Оба метода приводят к одинаковым результатам.
C


a
 b
b



P

A D c E
На рисунке 6 приведена треугольная диаграмма взаимной растворимости системы «вода (В) – ацетон (А) – хлороформ (С)» при постоянных температуре и давлении.
 A
A



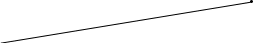
 K
K
d a1
 b1
b1
D B b a C
Состояние такой системы есть функция четырех термодинамических параметров: температуры, давления и концентраций двух компонентов. Поскольку температура и давление заданы (298 К и 1,1013 . 105 Па), то можно задавать в известных пределах произвольное значение еще двух параметров – концентраций, не изменяя числа фаз в системе в соответствии с правилом фаз Гиббса при Р,Т – const:
C = K – Ф
где С – число степеней свободы (вариантность ) системы; К – число компонентов; Ф – число фаз. Это значит, что на треугольной диаграмме область существования однофазных систем должна быть двухмерной, занимая часть треугольника состава.
Если в системе появится вторая фаза, т.е. если система окажется состоящей из двух сопряженных фаз (фаз, находящихся в равновесии), то число степеней свободы уменьшится и станет равным единице. Значит, при определенных температуре и давлении в трехкомпонентной двухфазной системе произвольно может значение концентрации только одного компонента в одной из фаз. Концентрации двух других компонентов при этом уже однозначно определяются. Таким образом, состав каждой из сопряженных фаз двухфазных трехкомпонентной системы есть функция одного параметра. Область существования каждой из сопряженных фаз должна, следовательно, выразится на треугольной диаграмме некоторой линией. Эти линии представляют собой две ветви бинодальной кривой. Так, на рисунке 6 ветвь bK отвечает растворам ацетона в водном слое, а ветвь аК – растворам ацетона в слое, богатом хлороформом. Прибавление двухфазной смеси из двух компонентов (воды и хлороформа) третьего компонента (ацетона) увеличивает взаимную растворимость. В результате этого ветви бинодальной кривой постепенно сближаются.
Отметив на соответствующих ветвях бинодальной кривой точки, отвечающие концентрациям ацетона, укажем фазовые точки двух сопряженных растворов ( точки а1 и b1). Соединив эти точки отрезком прямой, получим конноду а1b1. Любая точка конноды, например точка d , отвечает двухфазной системе, состоящей из тех же двух сопряженных растворов (а1 и b1). При этом массы сопряженных растворов, в соответствии с правилом рычага, обратно пропорциональны расстояниям от фазовых точек этих растворов до точки системы d: ma1/ma2 = b1d/a1d/
Если добавить к рассматриваемой системе новые порции третьего компонента (ацетона), то он будет неравномерно распределяться между двумя слоями. При этом на диаграмме наклон коннод будет возрастать. Определять направление коннод с помощью закона распределения становится невозможно, так как при больших концентрациях С1 и С2 и значительной взаимной растворимости самих растворителей закон распределения усложняется. Поскольку при добавлении к системе третьего компонента увеличивается взаимная растворимость первых двух компонентов, то длина конноды постепенно уменьшается и при определенном составе системы, отвечающем точке К, обе ветви бинодальной кривой сходятся, составы обоих сопряженных растворов совпадают и система становится однофазной.
Составы сопряженных растворов и направление коннод в области составов системы, близкой к критической точке, можно определить, пользуясь приближенным эмпирическим правилом Тарасенкова. Согласно этому правилу продолжение всех коннод для данной области расслоения пересекаются приблизительно в одной точке (точка D на рисунке 6). Это правило применимо лишь к простейшим системам взаимной растворимости трех жидкостей.
