
- •Химическая термодинамика
- •Часть 1
- •Термохимия
- •Цель работы
- •Теоретическая часть
- •Экспериментальная часть
- •Порядок выполнения работы
- •Обработка результатов эксперимента
- •Расчет теплоты образования твердого раствора kCl . RBr
- •Определение изменения температуры в калориметрическом опыте
- •Расчет теплоты образования кристаллогидрата
- •Контрольные вопросы
- •II. Изучение равновесия гомогенной реакции в растворе
- •Цель работы
- •Теоретическая часть
- •Экспериментальная часть
- •Порядок выполнения работы
- •Обработка экспериментальных данных
- •Контрольные вопросы
- •III. Определение коэффициента распределения иода между органическим и неорганическим растворителями
- •Цель работы
- •Теоретическая часть
- •Экспериментальная часть
- •3.2. Порядок выполнения работы
- •Обработка результатов эксперимента
- •Контрольные вопросы
- •IV. Изучение взаимной растворимости в трехкомпонентных системах
- •Цель работы
- •Теоретическая часть
- •Экспериментальная часть
- •Порядок выполнения работы
- •Обработка экспериментальных данных
- •Контрольные вопросы
- •Литература
- •Содержание
- •Термохимия
Экспериментальная часть
Приборы и реактивы : термостат, колбы мерные с притертыми пробками емкостью 100 см3, колбы конические для титрования емкостью 100 см3, пипетки, бюретка, 0,03 М раствор Fe2(SO4)3, 0,03 M раствор RJ, 0б\,015 М раствор Na2S2O3, раствор крахмала.
Порядок выполнения работы
Взять четыре пронумерованные сухие мерные колбы емкостью 100 см3, налить в них растворы в соответствии с таблицей 2
Таблица 2
Раствор, см3 |
Колба 1 |
Колба 2 |
Колба 3 |
Колба 4 |
0,03 М Fe2(SO4)3 |
50 |
- |
55 |
- |
0,03 М KJ |
- |
50 |
- |
45 |
Приготовить для титрования 8 конических колб емкостью 100 см3. В каждую колбу налить 30-35 см3 дистиллированной воды и поставить для охлаждения в лед.
Слить вместе содержимое 1 и 2 колб, отметив момент сливания по часам. Через 10 минут слить содержимое 3 и 4 колб и также отметить время. Колбы плотно закрыть пробками. Через 20 минут после сливания из каждой колбы отобрать пипеткой 15 см3 раствора и поместить их в колбы для титрования с охлажденной водой. Время отбора пробы считать с точностью до 1 минуты. Сразу после сливания выделившийся иод титровать 0,015 М раствором Na2S2O3 до бледно-желтой окраски. Затем добавить несколько капель раствора крахмала и титровать до исчезновения синего окрашивания. Отбор проб повторить через 40, 60, 80 минут от момента сливания. Одинаковое количество (см3) гипосульфита, израсходованное на титрование в двух последовательно взятых пробах из каждой колбы, указывает на достижения равновесия в реакции. Записать температуру опыта по комнатному термометру. Опытные данные занести в таблицу 3.
Таблица 3
Колбы |
Т, К |
Результаты титрования , VNa S O , см3 |
|||
Т1 |
20 мин |
40 мин |
60 мин |
80 мин |
|
1 – 2 3 – 4 |
|
|
|
|
|
Колбы |
Т2 |
10 мин |
20 мин |
30 мин |
40 мин |
1 – 2 3 – 4 |
|
|
|
|
|
Повторить эксперимент при другой температуре (по указанию преподавателя), помещая колбы с растворами в термостат и проводя отбор проб через 10, 20, 30 и 40 минут от момента сливания. Экспериментальные данные занести в таблицу 3.
Обработка экспериментальных данных
4.1.Концентрация иода в состоянии равновесия:
СJ
=
![]() .
.
4.2. Концентрация
ионов Fe2+
: CFe![]() = 2CJ
= 2CJ
4.3. Концентрация
ионов Fe3+
: CFe![]() = CFe
(SO
= CFe
(SO![]() )
- CFe
)
- CFe
где
CFe
(SO
)
=
C0
Fe
(SO
)
.
![]() ,
,
а и b – объемы раствор Fe2(SO4)3 и KJ соответственно, взятые для проведения реакции.
4.4. Концентрации
ионов J-
: СJ![]() = CKJ
– 2CJ
,
= CKJ
– 2CJ
,
где CKJ
= C0
KJ
.
![]() .
.
4.5. Константы равновесия для двух опытов при двух температурах :
К =
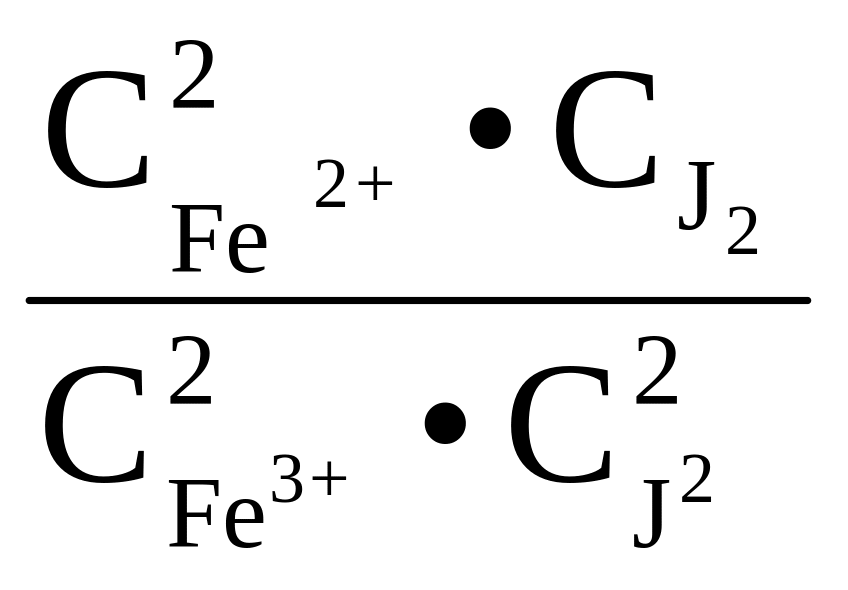 .
.
4.6. Среднее К для каждой температуры Т1 и Т2 :
КТ
=
![]() .
.
4.7. Занести в таблицу 4 для расчетов.
Таблица 4
Номер колбы |
Температура |
CJ |
CFe |
CFe |
СJ |
К |
Кср |
1 – 2 |
Т1 |
|
|
|
|
К1 |
КТ |
3 – 4 |
|
|
|
|
К2 |
||
1 – 2 |
Т2 |
|
|
|
|
К3 |
КТ |
3 - 4 |
|
|
|
|
К4 |
4.8. Рассчитать изменение свободной энергии Гиббса при двух температурах:
ΔG![]() = - RT1lnKT
,
ΔG
= - RT1lnKT
,
ΔG![]() = - RT2lnKT
,
= - RT2lnKT
,
где R = 8,314 Дж/моль . К
4.9. Рассчитать изменение энтальпии по уравнению изобары Вант-Гоффа:
а) аналитически из уравнения (13):
ΔН =
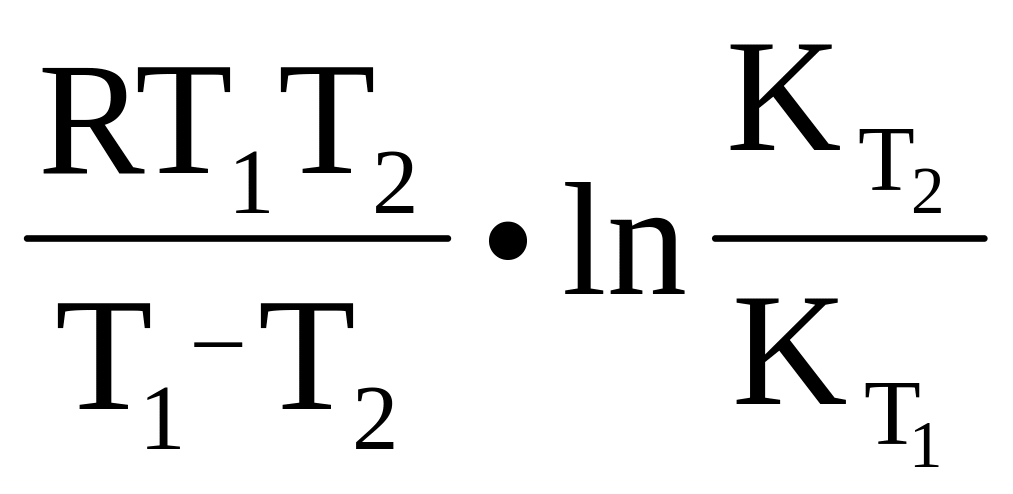
Б) графически из уравнения (12). Для этого необходимо построить график в координатах lnK = f(1/T) как показано на рисунке 3.
 ln K
ln K


 ln KT2
ln KT2

 ln KT1
ln KT1

1/T2 1/T1 1/T
Рис. 3
Найти коэффициенты в уравнении (12):
А =
![]() .
В1
= lnKT
.
В1
= lnKT![]() -
-
![]() В2
= lnKT
-
В2
= lnKT
-
![]()
В
=
![]()
Найти графическое значение изменения энтальпии из уравнения (12):
ΔНгр = - RA.
4.10. Записать уравнение зависимости К от Т в интегральной форме, подставив значения А и В.
4.11. Рассчитать изменение энтропии, Дж/моль . К:
ΔST
=
![]() ΔST
=
ΔST
=
![]()
Данные расчетов занести в таблицу 5.
Таблитца 5
Температура |
К |
А |
В |
ΔН, Дж/моль |
ΔG, Дж/моль . К |
ΔS, Дж/моль . К |
|
Т1 |
|
|
|
Анал. |
Граф. |
|
|
Т2 |
|
|
|
|
|
||
4.13 Сформулировать выводы о работе, оформить отчет.
