
- •Укладач: і. А. Василенко, канд. Техн. Наук
- •Укладач: василенко Інна Анатоліївна
- •1. Система «промислове підприємство - навколишнє середовище»
- •2. Хімічна термодинаміка в процесах природокористування
- •2.1. Ідеальні гази. Газові закони та рівняння стану
- •2.2. Рівняння стану реальних газів та коефіцієнт стискання
- •2.3. Фугітивність реальних газів
- •2.4. Перше начало термодинаміки. Тепловий баланс
- •3. Кінетика хіміко-технологічних процесів
- •3.1. Хімічна рівновага. Вплив зміни зовнішніх умов на рівновагу в процесах очищення
- •4. Забруднення навколишнього середовища та основні методи його захисту
- •4.1. Антропогенне навантаження на атмосферу великого міста
- •4.2. Розрахунок шумових характеристик потягу, що рухається
- •4.3. Оцінка екологічної ефективності технологічного процесу та оцінка природоохоронних заходів
- •5. Задачі
- •5.1. Задачі за темою «Хімічна термодинаміка в процесах природокористування»
- •5.2. Задачі за темою «Кінетика хіміко-технологічних процесів»
- •5.3. Задачі за темою «Забруднення навколишнього середовища та основні методи його захисту»
- •6. Список запропонованих тем для підготування доповідей
- •7. Перелік теоретичних питань, що входять у екзаменаційні білети
- •8. Список рекомендованої літератури
- •9. Додатки Додаток 1. Еколого-економічне зонування території України
3. Кінетика хіміко-технологічних процесів
Кінетика хімічних реакцій – це вчення про швидкість їх протікання і залежності від різних факторів (концентрації реагуючих речовин, температури, наявності каталізаторів і т.д.).
Під швидкістю хімічної реакції розуміють зміну концентрацій реагуючих речовин в одиницю часу.
По ступеню однорідності середовища, у якому здійснюються хімічні процеси, розрізняють реакції в гомогенні і у гетерогенних системах.
Гомогенна система – це система, термодинамічні властивості якої у всіх точках однакові.
Гетерогенна система складається з ряду гомогенних систем, які в цьому випадку називаються фазами. Фази відділені одна від одної реальними, мимовільними фізичними поверхнями розділу фаз, на границях яких деякі властивості змінюються стрибкоподібно. Гетерогенними називаються реакції, що протікають на поверхні розділу фаз або в об’ємі однієї фази гетерогенної системи.
І в тому і в іншому випадку для здійснення реакції необхідне безперервне підведення реагуючих речовин до поверхні розділу фаз, здійснюване дифузією.
Простими називають реакції, у яких взаємодія вихідних часток здійснюється в одну стадію при їхньому безпосередньому їх зіткненні. При цьому реакція, не обмежена в часі, закінчується повною витратою принаймні однієї з вихідних речовин. Таким чином, до простих реакцій відносять необоротні реакції, що йдуть в одному напрямку до кінця:
2А+В = А2В (3.1)
Встановлено, що швидкість взаємодії в простих реакціях при постійній температурі прямо пропорційна добутку концентрацій реагуючих речовин у ступені рівній стехіометричному коефіцієнту даних речовин у рівнянні реакції.
Відповідно до визначення швидкість V реакції (3.1) при їхніх концентраціях С складе:
V = k.CA2.CB. (3.2)
Коефіцієнт пропорційності k при постійній температурі є величиною постійною і називається константою швидкості реакції. Вона чисельно рівна швидкості реакції при концентрації кожного з вихідних речовин рівній одиниці.
У загальному випадку швидкість складних хімічних реакцій αA + βB → γD рівна:
![]() (3.3)
(3.3)
де k – константа швидкості реакції, що залежить тільки від температури;
СА, СВ – поточна концентрація речовин А и В;
и – порядок реакції по реагуючій речовині.
Порядок реакції по реагуючій речовині в загальному випадку може не збігатися з його стехіометричним коефіцієнтом у рівнянні реакції. У реальних хімічних процесах порядок реакції дорівнює сумі показників ступенів рівняння, що виражає залежність швидкості реакції від концентрації реагуючих речовин. Відомі реакції нульового, першого, другого і третього порядків (реакції більш високого порядку не зустрічаються). Однак частіше їх порядок виражається дробовим числом. Як правило, порядок реакції по речовині нижче, чим стехіометричний коефіцієнт цієї речовини, і завжди визначається експериментально.
У першім наближенні залежність швидкості реакції від температури визначається правилом Вант-Гоффа. Відповідно до нього при підвищенні температури на кожні 100С швидкість більшості хімічних реакцій збільшується в 2-4 рази. Правило Вант-Гоффа застосовують лише для орієнтовної оцінки впливу температури на швидкість реакції.
Температура впливає на швидкість реакції через зміну її константи швидкості. Сувора залежність останньої від температури виражається рівнянням Арреніуса:
![]() (3.4)
(3.4)
де Е – енергія активації, кДж/кмоль;
R– універсальна газова постійна. R = 8,314 Дж/(моль.К);
k0 – передекспоненційний множник.
Якщо при Т1 константа швидкості реакції рівна k1, а температурі Т2 відповідає константа k2, то енергію активації процесу можна виразити в такий спосіб:
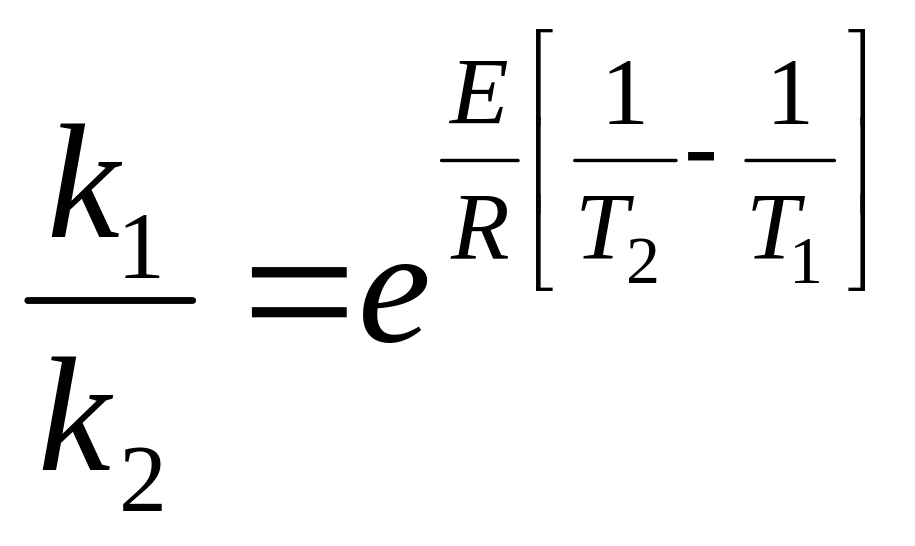 (3.5)
(3.5)
![]() (3.6)
(3.6)
З вище зазначеного випливає, що для розрахунків найпоширеніших реакцій, які мають перший і другий порядок мають місце наступні рівняння:
Для реакції першого порядку A → D
Швидкість реакції першого порядку має вигляд рівняння (3.7):
![]() (3.7)
(3.7)
Знаючи, що число молей речовини А, яка прореагувала визначається як:
![]() ,
(3.8)
,
(3.8)
де
![]() –
початкове
число молів;
–
початкове
число молів;
![]() –
число
молей,
які прореагували.
–
число
молей,
які прореагували.
Те константу швидкості реакції першого порядку можна визначити в такий спосіб:
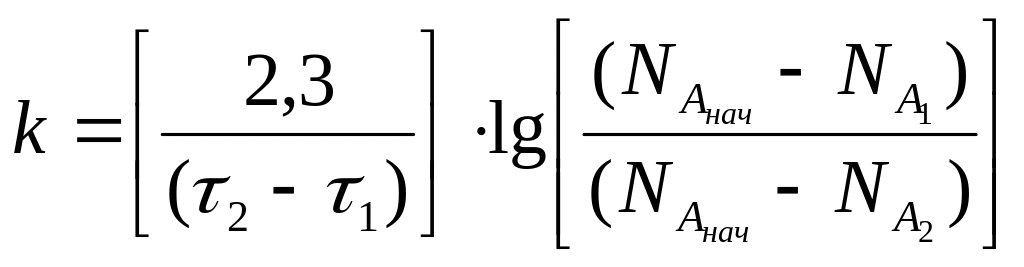 (3.9)
(3.9)
де τ1 и τ2 – час початку і завершення реакції.
Час напіврозпаду, тобто час, за який прореагує половина речовини, буде дорівнювати:
![]() (3.10)
(3.10)
Для реакції другого порядку А + В = С + D
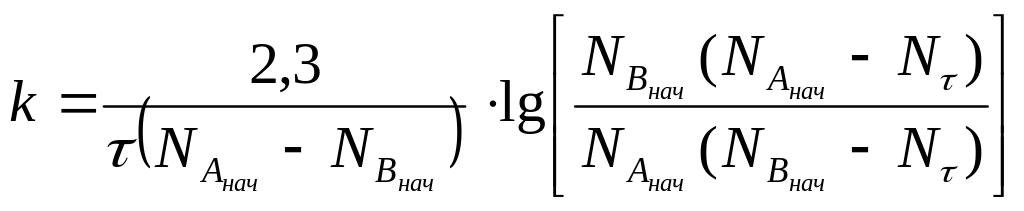 (3.11)
(3.11)
де
![]() –
кількість
компонента витраченого за час .
–
кількість
компонента витраченого за час .
Час напіврозпаду буде рівний:
![]() (3.12)
(3.12)
где С0 – початкова концентрація компонента в суміші.
