
- •1) Розрізняють три можливих механізми утворення пеш:
- •Теорія будови пеш
- •Модель пеш Гуї-Чепмена
- •1. Електроосмос
- •2. Електрофорез
- •3.Потенціал перебігу
- •4.Потенціал седиментації
- •Види стійкості дисперсних систем
- •Фактори стійкості дисперсних систем
- •Швидкість коагуляції
- •Гетерокоагуляція. Взаємна коагуляція колоїдів
- •3.Основи хімічної термодинаміки
- •Процеси є:
- •3.2 Закон Кіргофа
- •3.3 Основні принципи ( початки) термоденаміки.
- •3.3.2. II Початок термоденаміки.
- •3.3.4. Ііі Початок термодинаміки.
- •3.4. Термодинамічні потенціали
- •3.5. Критерії перебігу довільних процесів
- •3.6. Хімічний потенціал
- •4. Фізико-хмія поверхневих явищ
- •4.3 Адсорбція
- •4.3.1. Поверхнево-активні речовини.
- •4.3.4. Рівння адсорбції Гіббса
- •4.7.Когезія та адгезія
- •5.3.2. Диспергаційні методи одержання колоїдних систем.
- •5.3.2.1. Механісне диспергування
- •5.3.2.2. Ефект ребіндера.
4.7.Когезія та адгезія
Явища змочування і розтікання пов’язані з дією сил когезії і адгезії.
Когезія – це зчепність однорідних молекул, атомів чи йонів, за рахунок міжмолекулярних та міжатомного притягання всередині однієї фази.
Когезія визначає існування речовини у конденсованому ( рідкому чи твердому) стані.
Адгезія (прилипання) - це молекулярне тяжіння шляхом дії фізичних або хімічних міжмолекулярних сил між поверхнями двох різнорідних фаз ( твердих чи рідких), що межують,*
Кідькісно
когезію й адгезію характеризують
величинами роботи когезії (cohesion)
( )
та роботи адгезії (adhesion)
(
)
та роботи адгезії (adhesion)
( ).
).
Робота когезії дорівнює енергії, яку треба витратити для розірвання сил зчеплення між молекулами даної фази. Чилельно це дорівнює подвоєнному значенню поверхневого натягу.
 (4.26)
(4.26)
– це
робота, яку треба витратити для відізвання
молекул однієї фази. За величиною
можна оцінювати міцність адгезивного
зв’язку (міцності злипання, склеювання).
Для виявлення зв’язку між роботою
адгезії (
)
та поверхневим натягом доцільно
розглянути стовпчики двох рідин, що не
змішуються (А та Б ) ( рис.4.13) Розділимо
спільний стовпчик поверхневого поділу
А-Б. При цьому створюється дві нові
поверхні поділу: A
– повітря ( )
та Б – повітря (
)
та Б – повітря ( ),
для чого потрібна робота, що дорівнює
сумі
),
для чого потрібна робота, що дорівнює
сумі
 .
Оскільки при тім зникла поверхня поділу
А-Б (
.
Оскільки при тім зникла поверхня поділу
А-Б ( )
, то виділилась повна кількість енергії
, що дорівнює (
)
Отже:
(
)
, то виділилась повна кількість енергії
, що дорівнює (
)
Отже:
( )
(4.27)
)
(4.27)
Це співвідношення відоме, як рівняння Дюпре. З рівняння Дюпре (4-27) видно, що робота адгезії тим більша, чим більші поверхневі натяги кожної з фаз на межі з повітрям і чим менший поверхневий натяг на межі поділу між фазами А та Б .
Явище адгезії супроводжується зменшенням поверхневої енергії. Це означає, що при суміщенні різних фаз енергії Гіббсв системи зменьшеється на величину роботи когезії:
 (4.28)
(4.28)
Явище когезії й адгезії відіграють роль у друкарських і після друкарських процесах поліграфічного виробництва. Згадаймо хоча б процеси фарбо перенесення і закріплення фарб, відшаровування, склеювання, тощо.
5. Фізико-хімія дисперсних систем.
Термін “колоїдна” хімія, незважаючи на те, що його й сьогодні можна часто зустріти, має все ж історичне значення. Зараз на зміну йому прийшла нова “фізико-хімія дисперстних систем”, яка включає також поняття фізики та хімії поверхні.
5.1 Загальна характеристика дисперстних систем.
Дисперстними називають системи, що складаються з великої кількості малих частинок, розподілених у рідкому, твердому або газо-подібному середовищах.
Сукупність подрібленних частинок називається дисперсною фазою, яка знаходиться у дисперсійному середовищі – безперервній неподрібненій фазі.
Для дисперсних систем характерні три ознаки:
- гетерогенність.
-дисперсність.
-питома поверхня.
Усі особливості колоїдних дисперсних систем є функціями або наслідками цих ознак.
Гетерогеність, абр неоднорідність, чи багатофазовість свідчить про наявність міжфазової поверхні і пройесів, що відбуваються на міжфазових поверхнях поділу.
Дисперсність, або подрібненість визначається розмірами тіла за трьома його вимірами. Дисперсії речовин, вірніше її складові частини можуть мати різну форму:
Розгляньмо утворення дисперсної фази при зменшенні розмірів частинуи кубічної форми по трьох осях (рис.5.1)
При значному зменшенні розмірів в одному вимірі ( по осі Y) одержимо плівку, пбо пластину; при зменшенні розмірів куба у двох вимірах ( по осях X та Y ) одержимо капіляри. Зменьшення розмірів по всіх трьох осях (X,Y,Z) дає маленькі частинки. Дисперсність визначається величиною діаметра частинки (d). Або величиною, оберненою розміру діаметра (d):
D
=
 , де
D-дисперсність;
d-
середній діаметр частинки, або довжина
ребра, (
, де
D-дисперсність;
d-
середній діаметр частинки, або довжина
ребра, ( )
)
Вверх
Третя характеристика дисперсної системи.
Питома
поверхня –
 ,
,
 , де
, де
S- між фазова поверхня, V - об’єм дисперсної фази, m – маса дисперсної фази. Усі три характеристики дисперсних систем зв’язані між собою: зі зменшенням розмірів діаметра збільшується дисперсність та питома поверхня. Гетерогенність, або наявність між фазової поверхні передбачає наявність поверхневого натягу. Чим більша гетерогенність і чим різкіше відрізняються фази за природою, тим більший поверхневий натяг.
5.2. Класифікація дисперсних систем ( ДС ).
В основу загальної класифікації ДС покладена відміність в агренативному стані дисперсної фази (ДФ) і дисперсійного середовища (ДСр). За трьома агрегатними станами виділяють вісві ( дев’ять – один) типів ДС:
Дисперстна фаза |
Дисперсійне середовище |
Умовне позначення |
Назва системи |
Приклади |
Тверде тіло |
Тверде тіло |
Т / T |
Солодозолі, тверді золі |
Мінерали, сплави, фотоемульсії
|
Рідина
|
Тверде тіло
|
Р / T
|
Тверды емульсії,капілярні системи |
Грунт,рідина в поруватих тілах, гелі
|
Газ
|
Тверде тіло
|
Г/ T
|
Пористі тіла, тверда піна |
Пемза поролон, активне вугілля |
|
|
|
|
|
Тверде тіло |
Рідина |
Т / Р |
Лізолі, емульсії |
Друкарські фарби |
Рідина |
Рідина |
Р / Р |
Емульсії |
|
Газ |
Рідина |
Г/ Р |
Піна, газові емульсії, вспінена фарба |
|
|
|
|
|
|
Тверде тіло |
Газ |
Т / Г |
Дим,пил |
Паперовий пил |
Рідина |
Газ |
Р / T
|
Аерозолі, тумани, хмари
|
|
Газ
|
Газ |
Г / Г |
Дисперсні системи відсутні |
|
Отже умовно ДС позначають дробом, у якому чисельник вказує на агрегатний стан ДФ, а займенник – на ДСр.
З наведеної класифікації видно, що усі ДС за кінетичними властивостями ДФ та за структурою ДСр можна поділити надва класи:
I |
II |
Вільно дисперсні системи |
Зв’язано дисперсні |
Частинки ДФ рухомі |
Частинки ДФ нерухомі |
Приклад: друкарські фарби |
Приклади: папір, фарбо відбитки. |
Отже, вільно дисперсні системи мають ДФ рухому, а зв’язанодисперсні системи мають тверде ДСр, у якомучастинки ДФ не можуть вільно рухатись. Класийіковані за агрегатним станом ДС у свою чергу класифікуються за дисперсністю. Звязанодисперсні системи класифікують за розмірами пор: мікропористі – 2-200нм; макропористі – вище 200нм.
Вільнодисперсні системи класифікуються за розмірами частинок ДФ.
Тпи системи |
Розмір частинок, м |
Дисперсність , |
Прилади |
Грубодисперсна |
Більше
|
Більше |
Пісок, гравій, агреговані порошки |
Мікрогетерогенн |
|
|
Частинки видимі у звичайний мікроскоп. Піна, грунт, емульсії. |
Колоїдно0 дисперсна або ультрамікро- гетерогенна |
|
|
Частинки видимі тільки в ультра-, та електронні мкроскопи |
Молекулярні та йоні речовини |
Менший
|
Менше за |
Істинні ( справжні) розчини |
Залежно від агрегатного стану ДСр вільнодисперсні системи поділяюмься на : - Золі з газоподібним ДСр (аерозолі) та золі з рідким ДСр – лізолі( від lios ( грецька)- рідина ). За природою середовища лізолі поділяють на : гідрозолі ( середовище-вода) та оргаозолі ( середовище органічна рідина). Якщо органічна речовина (рідина) – спирт ( алкоголь), то органозоль називають алкоголем, якщо етер- етерозолем, а якщо естер- естерозолем. Наприклад друкарські фарби флексографічного або глибокого друку на бутилацетаті є есстерозолі. - Існує також класифікація за топографічною ознакою ( на відмінність форми частинок ): - Корпускулярні ( частинки ДФ малі у трьох вимірах) - Фібрилярні (волокнисті) (частинки ДФ малі у одному вимірі).
За термодинамічною стійкістю і характером утворення розрізняють ліофобні та ліофільні ДС.
Ліофобні утворюються з переначисенних систем внаслідок подрібнення великих частинок, тому вони термоденамічно не стійкі ( наприклад фарби, концентровані речовини).
Ліофільні ДС утворюються шляхом довільного диспергування. Отже, вони є термоденічно стійкими.
Класифікація за фазовою відмінністю:
Міцелярні ДС
Макромолекулярні ДС.
5.3. Методи одержання колоїдно-дисперсних систем.
З
наведеної вище класифікації дисперсних
систем зробити висновок, що колоїдні
розчини, або золі займають проміжне
положення між молекулярно йонними
розчинами з розмірамии частинок, меншими
за (
м
) (1 нм) та мікрогетерогенними грубодисперсними
системами з розмірами частинок
(d= м).
Отже золі – це дисперсні систем из
розмірами частинок від
до
м),
або 1-100нм, т.т їхній розмір менше довжини
хвилі світла видимого діапазону ( як і
УФ).
м).
Отже золі – це дисперсні систем из
розмірами частинок від
до
м),
або 1-100нм, т.т їхній розмір менше довжини
хвилі світла видимого діапазону ( як і
УФ).
Існує два методи одержання колоїдних розчинів: конденсаційний та диспергаційний (т.т. можна скласти частинки з менших або подрібнити крупні частинки).
Рим.5.2.
Конденсація Диспергування
Рис.5.2. Одержання колоїдних розчинів.
Конденсаційний метод полягає в утворенні дисперсних частинок за рахунок агрегації молекул або йонів.
Диспергіційний метод полягає у подрібленні великих частинок грубої дисперсії до стану колоїдної дисперсності. Отже, в обох методах суть полягає у створені нової фаз из колоїдним ступенем дисперсності.
5.3.1. Кондесаційні методи
Кондесаційні методи поділяються на методи:
Фізичної та хімічної
Конденсації.
Загальна умова для створення нової фази – стан перенасичення розчину або пари, внаслідок чого утворюється агрегат из кількох молекул, які стають зародками нової фази. Чим більша кількість зародків ( центрів кристалізації) і менша швидкусть зростання агрегатів ( кристалів), тим вища дисперсність золю.
5.3.1.1. Фізична конденсація
- Заміна розчинника.
При додаванні невеликої кількості істинного розчину речовини до розчинника, в якому ця речовина нерозчинна або малорозчинна, відбувається видцлення речовини у вигляді високодисперсної системи. Наприклад, каніфоль розчинається в єталоні з утворенням істинного розчину. При додаванні до такого розчину води, яка не розчиняє каніфоль, утворюється стійкий зольканіфолю. ( як правило спиртовий розчин додають до води).
-Конденсація пари
При прпусканні пари речовини у рцдину при кондеснації пари утворюється золь.
До цього методу можна віднести одержання дисперсій металів, що розпорошують у вольтовійдузі або в іскровому високочастотному розряді в органічній речовині або воді. Цікавий метод Рогинського-Шальникова одержання гідрозолів та органозолів високого ступення чистоти. Суть методу видно з (рис.5.3)
Рис.5.3.
Цим методом одержали органозолі сірки селену, фосфору, калію, натрію, олива (свинцю)
Чи можна отримувати методом фізичної конденсації ( Рогинського-Шальникова) – золі алюмінію та забарвлених алюмінієвих дисперсій, т.т. чи можна отримати металізовані друкарські фарби?
- або люмінорні системи ( дисперсна фаза – люмінофори, зокрема люмінори, тобто органічні люмінофори)?
- або пігментнізолі (т.т. пігментовані фарби)?
-Чи системи олея – вода та вода – олія ?
5.3.1.2. Хімія конденсація.
При хімічній конденсаціі нова тверда фаза виникає внаслідок
реакцій, продуктами яких є нерозчинні в реакційному середовищі речовини. Такими реакціями можуть бути подвійний оюмін, окислення – відновлення, гідроліз.
Високодисперні золі одержуютьпри внесенні в розведений розчин одного реагкнту невеликої кількості концентрованого розчину другого реактиву. Останній відіграє роль стабілізатора. Нова дисперсна фаза спочатку досить часто має аморфну будову і складається з агрегатів нерозчиненної речовини. З часом тверда фаза набуває кристалічної структури.
Отже, для одержання золю необхідно виконати три головні умови:
-Дисперсна фаза повинна бути нерозчинна у дисперсійному середовищі;
- система повинна мати стабілізатор, який надає ій стійкості ( концентрований розчин одного з реагентів можливо полімер, ПАР);
-розмір дисперсної фази м
В основу більшості кондесаційних методів одержання колоїдних розчинів покладено різномаанітні хімічні реакції.
-Так, реакції подвійного обміну дозволяють одержати золі важкорозчинних сполук.

Умова:? Один з реагентів є у надлишку.Тоді йодид срібла не випадає в осад, а утворює колоїдний розчин.
 або
або
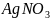 надлишок
надлишок
 – важко
розчинна сполука
– важко
розчинна сполука
Реакції відновлення ( одержання золю срібла )

Прозорі для видимого світла золі срібла використовують, наприклад, як фільтрові шари в кольорових фотографічних матеріалах, що розглядатимуться в курсі “Теорія фотографічних процесів”
Реакції окиснення (одержання золю сірки)

Реакції гідролізу ( золі гідроксидів і основних солей важких металів)



Фізично-хімічне диспергування, або пептизація. Ці методи формально відносяться до диспергаційних, але мають фізично-хімічний характер.
Конкретні приклади хімічних та фізичних методів одерження золів будуть наведені пізніше.
Для їх глибшого розуміння розглянемо будову колоїдних частинок.
5.3.1.3.. будова колоїдних частинок ліофобних золів.
Існує міцелярна теорія будови таких систем. Згідно з нею золь складаєтсья з двох частин: міцел та інтерміцелярної рідини.
Міцела- це структура колоїдна частинка дисперсної фази.
Інтерміцелярна, тобто міжмілярна рідина є дисперсійним середовищем. У ньому розчинені елетроліти, неелектроліти, ПАР, які стабілізують колоїдну систему. На теперішньому етані розвинку колоїдної хімії будову міцели можна уявити лише в першому наближенні.
Розглянемо будову золю йодиду срібла, що утворюється за реакцією ( стор.98)
надлишок.
Основу
колоїдних частинок золю
складають мікрокристали важкорозчинного
,
які містять у собі m
молекули
,
а точніше пар іонів
 і
і
 .
Мікрокристали m
(
)
називають агрегатами. Якщо реакція
відбувається при надлишкові
,
то згідно з правилом Панета-Фаянса
внаслідок вибіркової адсорбції йонів
,
на поверхні агрегату виникає від’ємно
заряджений шар з йонів
.
Йони йоду є потенціал визначальними
іонами (ПВЙ).
.
Мікрокристали m
(
)
називають агрегатами. Якщо реакція
відбувається при надлишкові
,
то згідно з правилом Панета-Фаянса
внаслідок вибіркової адсорбції йонів
,
на поверхні агрегату виникає від’ємно
заряджений шар з йонів
.
Йони йоду є потенціал визначальними
іонами (ПВЙ).
Агрегат разом з (ПВЙ), які міцно адсорбувались на його поверхні й увійшли у кристалічну гратку агрегата, є частинкою твердої фази, що називають ядром.
Під
дією електростатичних сил до поверхні
ядра притягуються іони протилежного
знаку – протийони. Вони компенсують
заряд ядра та відновлюють порушену
електронейтральність системи. В даному
випадку це іони
 .
.
Останні не приєднуються міцно до поверхні ядра, оскільки утворюються з поверхнею ядра добре розчинну сполуку (КІ).
Частина пройонів (n-x) , що зазнає дії електростатичних і ван-дер-вальсових сих ядра, тримається досить близько біля нього й утворює адсорбційний шар протийонів. Ця частина протийонів [(n-x) знаходиться в шарі, що змочує тверду поверхню ядра. Концентрація протийонів біля поверхні більша, ніж у розчині. Тому решта х протийонів( ) слабшає зв’язана з ядром ( діють тільки кулонівські сили) і внаслідок теплового руху дифундує в об’єм з меншою концентрацією.
Протийони розташовуються в рідкій фазі дифузно ( розсіяно). Тому шар, який вони утворюють, називають дифузійним (дифузним). Таким чином, агрегат, ядро, адсорбційний шар утворюють гранулу, заряд якої визначається знаком заряду потенціал визначальних йонів, а гранула разом з дифузійним шарои утворює міцелу (рис.5.4.) .
Міцели золів електонейтнальні. Можна записати структуру міцели і її складових:
m(AgI)
–агрегат, (m(AgI - ядро , {
[m(AgI
(n-x
- ядро , {
[m(AgI
(n-x – гранула,
– гранула,
{ [m(AgI (n-x x – міцела.
(агрегат ПВЙ – адсорбційний шар, дифузійний шар) – міцела,
m – кількість молекул в агрегаті, n- кількість ПВЙ – іонів,
(n-x)- кількість протийонів, що входять до адсорбційного шару,
x- кількість протийонів, що входять до дифузійного шару .
Межа між гранулою та дифузійним шаром – межа або поверхня ковзання. Межа ковзання вказує на геометричну поверхню, яка розділяє (розриває) міцелу при її переміщені відносно дисперсного середовища.
Отож, можемо зробити висновок, що на поверхні кристалу AgI виник подвійний електричний шар (РЕШ), який складається:
-з потенціал визначених іонів
-
і протийонів ( )
розташованих в адсорбційному шарі
(кількість їх (n-x),
та в дифузійному шарі (кількістю x-іонів).
)
розташованих в адсорбційному шарі
(кількість їх (n-x),
та в дифузійному шарі (кількістю x-іонів).
Це ми розглядаємо випадок, коли при взаємодії з KI у найдишку був КІ. А якщо у надлишку буде , то гранула матиме позитивний заряд.
Потенціал
визначеними йонами будуть
 іони, а проти іонами –
іони, а проти іонами –
 -цони,
які розташовуватимуться в адсорбційному
шарі в кількості (n-x)
), а в дифузійному шарі – в кількості
x
.
-цони,
які розташовуватимуться в адсорбційному
шарі в кількості (n-x)
), а в дифузійному шарі – в кількості
x
.
Отже ми розглянули будову міцели і її утворення на прикладі рекції подвійного обміну. Як вище зазначалося, конденсаційні методи одержання речовини у колоїдному стані можуть ґрунтуватись на різноманітних хімічних реакціях.

-методи очищення пол.систем діаліз ел.діаліз
Властивості дисп.систем. -оптичні властивості методи ( оптика + ел.міцели) -електричні - + електропептичні.
Стійкість і коагуляція
ПЕШ
Отже, ми розглянули будову міцели і її утворення на прикладі реакії подвійного обміну. Як раніше згадувалось, конденсаційні методи одержання речовини у колоїдному стані можуть грунтуватись на різноманітних хімічних реакціях. Розглянемо деякі з них. Реакція відновлювання: При додаванні до розчинів солей металів відновник ( наприклад, пероксиду водню, формаліну, спирту, білків) відбувається відновлення йонів металлу ( приєднання електрону) і вони перетворюються в атоми, які, збираючись в агрегати, дадають частинки металлу. Утворені частинки металлу також агрегують і в присутності надлишку солі металлу ( стабілізатор міцкл!) досягають колоїдних розмірів.
Для запобігання надмірному розмірів високомолекулярних сполук.
Макромолекули останніх адсорбуються на поверхні колоїдних частинок, утворюючи захисну плівку. Це сприяє стабілізації дисперсної системи.
Приклад: Одержання золю золота або срібла.
Під
час реакції утворюється стабілізатор
– сіль

Будова
міцели {
[m(Ag (n-x
x
–
Золь
золота можна одержати відновлюючи аурат
калію – розчинну сіль золота формальдегідом
(формаліном).
(n-x
x
–
Золь
золота можна одержати відновлюючи аурат
калію – розчинну сіль золота формальдегідом
(формаліном).
Тут
стабілізатор – аурат калію ( надлишок)
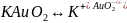
Будова
міцели
 (n-x
x
Окиснювально-відновні
реакції, що призводять до утворення
нерозчинної фази внаслідок окиснення
певного відновника, відносять до реакцій
окиснення. (
чи
окиснення)
(n-x
x
Окиснювально-відновні
реакції, що призводять до утворення
нерозчинної фази внаслідок окиснення
певного відновника, відносять до реакцій
окиснення. (
чи
окиснення)

Якась частка сірки ( сульфура) окиснюється далі з утворенням тоінових (тіо – від грецького сірка) кислот, наприклад пентатіонової кислоти, які ( яка) є стабілізатором, ав загальній формі
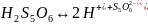

Структура
міцели {
[m(S (n-x
(n-x x
x
Реакції гідролізу часто використовують для одержання золів гідроксидів металів, наприклад золю гідроксиду заліза і основних солей заліза.
Можливо також:
Можливі структури міцел золю
Методи хімічної конденсації дають можливості одержати стабільні золі, особливо якщо одночасно з важкорозчинними сполуками утворюються неелектроліти або слабкі електроліти.
Відомо, що для виробництва друкарських фарб використовують нерозчинні забарлюючі речовини – пігменти, а токож так звані лаки барвників – нерозчинні або слаборозчинні солі катіонів барвників аніонами гетерополікислот,або аніонів барвників з катіонами барію, калію, тощо.
Отже, використовуючи реакції обміну можна виготовляти лаки барвників і отримувати дрібнодисперсні друкарські фарби. До речі такі фарби і фарбовідбитки можуть зазнавати змін у вологих приміщеннях через реакціх гідролізу.
5.3.1.4 Фізично-хімічне диспергування або пептизація
Пептизація-
це дезагрегування частинок осаду
розпушенної структури, між якими є
прошарок дисперсійного середовища.
Тобто фактично це не є диспергування у
його прямому визначенні.

Зовнішньо процесс переходу осадів у колоїдний стан нагадує процесс розчинення денатурованих білків під дією ферменту пепсину. Звідси походить термін “Пептизація”.
Адсорбціййна пептизація. Якщо до осаду додавати електро літи, до складу якого входять іони, здатні до вибіркової адсорбції на осаді згідно з правилом Панета-Фаянса, то такий осад піддається пептизації. Наприклад, осад Fe(OH)3 можна одержати за реакцією:
Перехід від осаду до міцели.
m[Fe(OH)3]![]() {[m
Fe(OH)3·nFe3+]3n+
3(n – x)Cl-}3x+3xCl-
{[m
Fe(OH)3·nFe3+]3n+
3(n – x)Cl-}3x+3xCl-
Золь гідроксиду заліза можна одержати, якщо обробити осад розчином, що містить іони Fe3+ (тобто йон-пептизатор).
Хімічна або дисолюційна пептизація відбувається при додаванні до осадів, які не мають ПЕШ на своїх частинках, рочину речовин, що вступають в реакцію з поверхнею осадів. Важливо при цьому, аби кількість реагенту, що розчиняє осад, була дуже малою. Інакше може розчинятися весь осад.
В процесі розчинення утворюється електролит-пептизатор, який пептизує ту частину осаду, що залишається.
Наприклад, для пептизації осаду Fe(OH)3 обробляють невеликою кількістю розчину HCl.
Рівняння (с.108.)
Це можна визначити як йонну хімічну пептизацію.
Можлива
молекулярна хімічна пептизація,наприклад
при додаванні до осаду неелектолитів:
багатоатомних спиртів, органічних
кислот. Молекули неелектролитів:
багатоатомних спиртів, органічних
кислот. Молекули неелктролитів
адсорбуються на частинках осаду і
захищають їх від злипання.

Пептизація промиванням розчинником ( дисперсійним середовищем). Таким способом пептизують осади, які було одержано при значному надлишку одного з реагентів. У цьому разі на частинках осаду є ПЕШ, але він сильно стиснутий за рахунок високої концентрації елетролиту і електростатичні сили відштовхування між частинками одразу не появляються. Для отирамання колоїдного стану треба відновити нормальну структуру ПЕШ, для чого необхідно зменшити концентрацію електролиту в осаді. При промиванні осаду чистим розчинником або дисперсійним середовищем надлишок електролиту вимивається і утворюється стійкий золь.
Наприклад міцели золю Fe(OH)3
До промивання {[m[ Fe(OH)3]nFe3+]3n+ 3nCl-}0
після промивання: формула на (с.109.) Заряди колоїдних частинок (3x+) створюють сили відштовхування між ними і сприяють переходу осаду в колоїдний стан.




