
- •1) Розрізняють три можливих механізми утворення пеш:
- •Теорія будови пеш
- •Модель пеш Гуї-Чепмена
- •1. Електроосмос
- •2. Електрофорез
- •3.Потенціал перебігу
- •4.Потенціал седиментації
- •Види стійкості дисперсних систем
- •Фактори стійкості дисперсних систем
- •Швидкість коагуляції
- •Гетерокоагуляція. Взаємна коагуляція колоїдів
- •3.Основи хімічної термодинаміки
- •Процеси є:
- •3.2 Закон Кіргофа
- •3.3 Основні принципи ( початки) термоденаміки.
- •3.3.2. II Початок термоденаміки.
- •3.3.4. Ііі Початок термодинаміки.
- •3.4. Термодинамічні потенціали
- •3.5. Критерії перебігу довільних процесів
- •3.6. Хімічний потенціал
- •4. Фізико-хмія поверхневих явищ
- •4.3 Адсорбція
- •4.3.1. Поверхнево-активні речовини.
- •4.3.4. Рівння адсорбції Гіббса
- •4.7.Когезія та адгезія
- •5.3.2. Диспергаційні методи одержання колоїдних систем.
- •5.3.2.1. Механісне диспергування
- •5.3.2.2. Ефект ребіндера.
1) Розрізняють три можливих механізми утворення пеш:
Завдяки обміну йонами (або електронами) між фазами або внаслідок переходу йонів (електронів) з однієї фази в іншу (поверхнева йонізація).
У результаті переважної адсорбції йонів одного знаку. Йони протилежного знаку притягаються до поверхні електростатичними силами. Визначення заряду поверхні проводять згідно з правилом Пане-Фаянса.
Через адсорбційну орієнтацію полярних молекул спряжених фаз внаслідок їхньої взаємодії:
а) якщо у формуванні ПЕШ беруть участь електроліти – то властивості ПЕШ визначаються електростатикою.
б) якщо ж електроліти не беруть участь, то для визначення знаку поверхні використовують правило Кйона:
з двох спряжених фаз позитивно заряджається фаза з більшою діелектричною проникністю (ɛ). Оскільки діелектрична проникність (ɛ) води велика, то речовини, які перебувають з нею в контакті, заряджаються негативно, наприклад, частинки глини у воді чи частики пігменту у водних чи водноспиртових друкарських фарбах.
Незалежно від механізму утворення ПЕШ на межі поділу твердої та рідкої фаз виникають певні електричні потенціали.
Потенціалвизначальні йони (ПВЙ), фіксовані твердою поверхнею, створюють так званий поверхневій, або φs-потенціал. Його знак збігається зі знаком ПВЙ.
Величина φs-потенціалу пропорційна кількості адсорбованих іонів на зарядженій поверхні.
Якщо ПЕШ утворюється через дисоціацію твердої речовини або адсорбцію йонів, то електричний потенціал визначається активністю цих іонів у розчині, тому що частинка діє як зворотній електрод відносно цих іонів. У такому раці φs-потенціал можна виразити рівнянням Нернста:
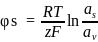
де Я – заряд ПВІ;
F – стала Фарадея;
a0, ap, as, av – активність іонів відповідно на поверхні та в розчині.
Пригадаймо, що електрична робота переведення (вільна енергія) 1 моля іонів з металу в розчин:
А = nFl,
де n – число електронів, що втрачає атом металу;
l – потенціал електрода;
F – стала Фарадея.
Отже рівняння для φs-потенціалу відноситься до 1 молю (1 грам-йону) і може бути записане:

З точки зору термодинаміки φs-потенціал є вільна енергія (робота) переносу одиниці позитивного заряду з нескінченно віддаленої точки об’єму розчину з рівною концентрацією позитивних і негативних зарядів на поверхню твердої фази. Тобто це потенціал твердої фази.
Другий потенціал, який характеризує ПЕШ, є електрокінетичний, або ξ-потенціал. Це електричний потенціал, що виникає у подвійному шарі на межі між частинкою та рідиною, що оточує її. ξ-потенціал є стрибком потенціалу поверхні «ковзання».
З точки зору термодинаміки ξ-потенціал можна визначити як роботу перенесення поодинокого заряду з нескінченно віддаленої точки об’єму розчину з потенціалом, рівним нулю, на поверхню «ковзання» з потенціалом, рівним ξ.
ПЕШ слід розглядати як єдину електронейтральну систему, в якій сумарна кількість протийонів дорівнює заряду твердої поверхні (внутрішня обкладка ПЕШ, як електричного конденсатора). Зовнішня обкладка ПЕШ (шар протийонів) складається з двох частин: щільної та розрідженої, або дифузійної (дифузної).
