
- •1) Розрізняють три можливих механізми утворення пеш:
- •Теорія будови пеш
- •Модель пеш Гуї-Чепмена
- •1. Електроосмос
- •2. Електрофорез
- •3.Потенціал перебігу
- •4.Потенціал седиментації
- •Види стійкості дисперсних систем
- •Фактори стійкості дисперсних систем
- •Швидкість коагуляції
- •Гетерокоагуляція. Взаємна коагуляція колоїдів
- •3.Основи хімічної термодинаміки
- •Процеси є:
- •3.2 Закон Кіргофа
- •3.3 Основні принципи ( початки) термоденаміки.
- •3.3.2. II Початок термоденаміки.
- •3.3.4. Ііі Початок термодинаміки.
- •3.4. Термодинамічні потенціали
- •3.5. Критерії перебігу довільних процесів
- •3.6. Хімічний потенціал
- •4. Фізико-хмія поверхневих явищ
- •4.3 Адсорбція
- •4.3.1. Поверхнево-активні речовини.
- •4.3.4. Рівння адсорбції Гіббса
- •4.7.Когезія та адгезія
- •5.3.2. Диспергаційні методи одержання колоїдних систем.
- •5.3.2.1. Механісне диспергування
- •5.3.2.2. Ефект ребіндера.
4.3.4. Рівння адсорбції Гіббса
Адсорбція на межі поділу рідина-газ, рідина-рідина. Як з’ясував Гіббс, розподіл розчиненої у розчині речовини відбувається так,що при цьому досягається максимальне зменшення поверхневого натягу.

Рівняння
Гіббса є матиматичним обгрунтіванням
загального правила: речовина, яка зменшує
поверхневий натяг, концентрується у
поверхневому шарі, і навпаки. Якщо σ
зменьшеться при збільшенні с , то
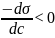 і адсорбція (Г > 0) буде мати додатнє
значення. Така адсорбція позитивна.
Якщо ж
і адсорбція (Г > 0) буде мати додатнє
значення. Така адсорбція позитивна.
Якщо ж
 і σ збільшується зі зростанням
концентрації розчиненної речовини, то
адсорбція буде негативною.
і σ збільшується зі зростанням
концентрації розчиненної речовини, то
адсорбція буде негативною.
Граничне
значення
 при c
при c
 0
-(
0
-( g-
поверхова
активність,
g-
поверхова
активність,

Корисними на практиці є правило Дюкло-Таубе:
Поверхнева активність (g) дифільних молекул ( жирнрих кислот, спиртів т.і. )
У
водних розчинах однакової концентрації
збільшується у 3-3.5 рази зі збільшенняч
довжини карбогідроненого радикалу на
одну (-C -)
группу:
-)
группу:
 та
та

Користуючись правилом Дюкло-Таубе можна підібрати ПАР потрібної поверхневої активності.
Для визначення адсорбції будують ізотерму поверхневого натягу Г. ( рис.4.6, 4.7)

Із залежностей (рис.4.6) знаючи кут нахулу ( АЛЬФА), визначають адсорбцію:
 (4-5)
(4-5)
При високих концентраціях Г досягає свого граничного значення ( Г∞) і далі не змінюється ( рис. 4.7)
( Г ∞ ) - постійна для всіх членів гомологічного ряду ПАР.
4.3.5. Адсорбція на межі тверде тіло-газ.
Усі випадки поглинання газів і пари твердими тілами називають сорбцією. Якщо процес сорбції відбувається тільки на поверхні, то його називають адсорбцією.
Адсорбцією – явище, коли речовинна , що поглинається поверхнею, дифундує у середину (об’єм) поглинаючої речовини і розподіляється по об’єму.
Верде тіло, на поверхні якого відбувається адсорбція, називають адсорбентом, а речовину , яка адсорбується адсорботивом або адсорбатом.
Процес,
протилежний адсорбції – десорбція.
Десорбція – це відокремлення адсорбованих
молекул з поверхні шару адсорбенту.
Коли швидкість десорбції зрівнюється
зі швидкістю адсорбції наступає
адсорбційна рівновага ( Природа адсорбційних сил може бути:
специфічна (хімічна) та неспецифічна
(фізична).
Природа адсорбційних сил може бути:
специфічна (хімічна) та неспецифічна
(фізична).
Отже розрізняють 2 види адсорбції: хімічну та фізичну.
Першу називають також хемосорбцією. Фізична адсорбція зумовлена взаємодією поверхневих молекул адсорбенту з молекулами адсорбату. При цьому молекули адсорбату не втрачають своєї індивідуальності.
Адсорбція відбувається тільки на певних ділянках адсорбенту, які мають надлишкову поверхневу енергію порівняно з площею поверхні.
Для фізичної адсорбції характерна швидка оборотність процесу адсорбція-десорбція, зменшення адсорбції з підвищенням температури. Хімічна ж адсорбція часто зростає.
Адсорбція залежить від тиску газу над поверхнею твердого адсорбенту.
4.3.5.1 Рівняння адсорбції Ленгмюра.
Адсорбція газів твердим адсорбентом ( позначають також А) описується рівнянням Ленгмюра:
 ,
де:
К- коефіцієнт пропорційності,
,
де:
К- коефіцієнт пропорційності,
Р- тиск газу ( пари).
Ізотерма адсорбції Ленгмюра може нагадувати ізотерму адсорбції Гіббса
(рис.4.7, 4.8)
При
низьких Р рівняннях Ленгмюра перетворюється
у вираз:

Тобто поверхнева концентрація газу Г прямо пропорційна тискові Р ( рис.4.7, ділянка (І)
При
високих Р Р>>К і Г= т.ч.
кількість адсорбованих молекул дорівнює
кількості активних центрів і адсорбція
досягає граничного значення
(рис.4.8. ділянка (ІІІ)
т.ч.
кількість адсорбованих молекул дорівнює
кількості активних центрів і адсорбція
досягає граничного значення
(рис.4.8. ділянка (ІІІ)
4.4 Адсорбція на межі поділу тверде тіло-розчин.
Ізотерми адсорбції розчинених речовин із розчинів аналогічні ізотермам адсорбції газів. Для розведеннх розчинів ці ізотерми досить добре підпорядковуються рівнянню Ленгмюра.
Адсорбція з розчинів порівняно з газовою адсорбцією має певні особливості:
1) На поверхні шару разом з молекулами розчиненої речовини можуть адсорбуватись і молекули розчинника. Тому можливі два різновиди адсорбції: додатна і від’ємна. В останньому випадку молекули розчинника краще адсорбуються за молекули розчиненої речовини.
2) Адсорбція з розчинів відбувається повільніше від адсорбції газів. Для прискорення встановлення адсорбційної рівноваги систему перемішують.
3) Підвищення температури розчину зменшує адсорбцію, але не так сильно, як адсорбцію газів.
В залежності від природи розчиненої речовини ( молекули чи йони) адсорбцію поділяють на молекулярну та йонну.
Таким чином, на адсорбцію з розчинів впливають природа розчиненої речовини, природа розчинника, природа адсорбенту.
4.4.1 Адсорбція електролітів.
Електроліти у водних розчинах знаходяться у вигляді йонів. Тому адсорбцією сильних електролітів з розчинів називають йонною.
Йонна адсорбція – це хімічна реакція між йонами розчиненої речовини і твердою поверхнею адсорбенту. Енергії нового хімічного зв’язку недостатньо для того, щоб відірвати поверхнево активні атоми адсорбенту. Тому зберігаються зв’язок нової сполуки з твердим адсорбентом.
Адсорбція йонів відбувається за двома основними механізмами:
1 – вибіркова адсорбція йонів на кристалах.
2 – еквівалентна або іонообмінна адсорбція.
4.4.2 Вибіркова адсорбція.
Вибіркова адсорбція визначається вибірковістю адсорбції катіона або аніона.
Правила вибіркова адсорбції сформульовано Панетом і Феянсом.
Перше правило: Кристалічну гратку адсорбенту добувають ті йони, що входять до її складу, ізоморфні з її йонами й утворюють з йонами цієї гратки важкорозчинні сполуки.
Друге правило: На твердій поверхні адсорбенту адсорбуються тільки ті йони, знак заряду яких протилежний заряду поверхні адсорбенту.
4.5. Змочування.
Поверхневий натяг і міжмолекулярні взаємодії всередині фаз змочують процеси змочування і розтікання краплі рідини на тверді або рідинній поверхні, а також явища когезії та адгезії.
Змочування. Маленька крапля рідини на твердій поверхні може набути різної форми: або близьку до сферичної ( як крапля води на поверхні парафіну) вбо кляксу, оскільки розтікається по поверхні твердого матеріалу, подібного до краплі води на поверхні чистого скла. В першому випадку тверда поверхня не змочується рідиною, а в другому випадку змочується.
Явище змочування впливає на перебіг багатьох процесів в природі та техніці, зокрема в поліграфічних технологіях. Це явище є початковоюб стадією взаємодії рідин з твердими тілами.
За
кількістю фаз, які беруть участь у
процесі, можна виділити два різновиди
змочування:
Імерсійне та контактне.
Перший випадок відповідає ситуації повного занурювання твердого тіла в рідину. В зволожуванні беруть участь дві фази: рідина і тверде тіло. В другому випадку змочування проходить за участю трьох фаз: твердої, рідинної та газоподібної, наприклад, крапля рідини на твердій поверхні ( друкарська форма, папір, зокрема при струминному друці).
Кількісною мірою змочування є кут, що утворюється краплню і твердою поверхнею ( рис.4.9) Цей кут називають крайовим кутом змочування (_____).Значення (____) змінюється від 0 до 180(градусів). Велечину (___) відіграють між твердою поверхнею і дотичною до поверхні краплі в точці, спільній для усіх трьох фаз. Вимірювання кута проходять з боку рідини…

Рис 4.9
Зв'язок
між кутом змочування і поверхневим
натягом виражається рівнянням Юнга:

Де
( або звідки); (рис.4.10.)
 (4.10,
4.11)
(4.10,
4.11)
З рівняння Юнга випливає, що процесом змочування иожна керувати, змінюючи величини поверхневого натягу у системі. Найефективнішим методом є введення ПАР у рідинну фазу або попередня обробка твердої поверхні розчинами ПАР ( гідрофілізація або гідрофобізація). Таким чином можна впливати на величину змочування, викликаючи навіть його інверсію, тобто поверхня, що раніше змочувалась стає такою, що не змочується , і навпаки.
Повне
змочування спостерігається при умові:
 (4.12)
(4.12)
Повне
незмочування мало б бути при
 Але
повного незмочування ніколи не буває,
оскільки завжди є сили взаємодії між
рідиною та твердим тілом. Звичайно
вважають змочування, коли
Але
повного незмочування ніколи не буває,
оскільки завжди є сили взаємодії між
рідиною та твердим тілом. Звичайно
вважають змочування, коли
 ,
а при
,
а при
 – незмочування.
– незмочування.
Загальна закономірність процесів змочування виявляється в тому, що чим вища полярність рідини, тим менше її змочувальні властивості. Високо полярна ртуть ( меркурій) змочує тільки деякі метали. Вона змочує поверхні багатьох полярних речовин.
Органічні рідини (спирти, бензол, гас , гексан) змочують практично будь-яку поверхню.
Крайові кути змочування експериментально вимірюють, застосовуючи метод проектування краплі на екран за допомогою спеціального приладу або частіше, проектора.
4.5 Вибіркове змочування
Звичайний інтерес являє змочування на межі твердої фази з двома рідинами, що не змішуються. Ці явища проявляються, зокрема, в офсетному друкарському процесі (плоский друк).
Кожна рідина окремо може змочувати поверхню ( приміром друкарської форми). Але при сумісній одна рідина змочує поверхню звийно краще, ніж інша. Рідина, що змочує краще тверду поверхню, називається рідиною, що вибірково змочує. Очевидно, що молекули цієї рідини активніше взаємодіють з твердою фазою.
Розглянемо систему, що складається з твердої поверхні (Т), яка знаходиться в контакті з водою (В) та вуглеводнем ( позначимо О – олія або М – мастило ). Кут змочування завжди вимірюють з боку полярнішої рідини (В).
За
рівнянням Юнга

При
вибірковому змочуванні поверхні водою

Або

Це означає, що різниця полярності між твердою фазою і водою менше, ніж між твердою фазом і вуглеводнем ( олією).
Рис.4.11
Тверді поверхні, що вибірково змочуються, гідрофільними. В капілярі такі рідини утворюють угнутий меніск.
Коли ж тверде тіло краще змочується неполярною ( мало полярною) рідиною (О) меніск в капілярі буде опуклим і можна написати
 (4.15)
(4.15)
 0 або (4.16)
0 або (4.16)
 (4.17)
тобто
різниця полярностейміж твердою фазою
та вибірково змочувальною рідиною (О)
менша, ніж між твердою твердою фазою і
водою.
(4.17)
тобто
різниця полярностейміж твердою фазою
та вибірково змочувальною рідиною (О)
менша, ніж між твердою твердою фазою і
водою.
Тверді поверхні, що вибірково змочуються неполярними рідинами, називають гідрофобними або олеофільними.
Отож, можна з формулювати правило: з двох рідин змочує тверду поверхню та, у якої різниця полярностей з твердим тілом найменша, а енергія взаємодії найбільша.
У
випадку порошкоподібних або поруватих
матеріалів вимірювання кута змочування
 є складною проблемою. Тому використовують
дві інші характеристики процесу
змочування. Наприклад, можна кількісно
визначити калориметричним методом
теплоту змочування, яка виділяється
при занурюванні твердого тіла у рідину.
Теплоту змочування звичайно відносять
до одиниці поверхні (
є складною проблемою. Тому використовують
дві інші характеристики процесу
змочування. Наприклад, можна кількісно
визначити калориметричним методом
теплоту змочування, яка виділяється
при занурюванні твердого тіла у рідину.
Теплоту змочування звичайно відносять
до одиниці поверхні ( )
або
маси (кг) речовини.
)
або
маси (кг) речовини.
Змочування твердої поверхні рідиною призводить до утворення нової межі поділу фаз: тверде тіло – рідина замість вихідної межі тверде тіло – газ повітря). Це супроводжується зменшенням поверхневої енергії Гіббса.
Теплота змочування дорівнює зміні повної поверхневої енергії одного кілограму твердої речовини при перенесенні її з повітря у рідину і пов’язана зі зміною поверхневої енергії Гіббса-Гельмгольца.

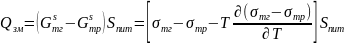
Де:
 -
поверхнева енергія одиниці поверхні;
-
поверхнева енергія одиниці поверхні;
 – питома поверхня твердої речовини, (
/
кг).
σ – поверхневий натяг;.
– питома поверхня твердої речовини, (
/
кг).
σ – поверхневий натяг;.
 – теплота змочування.
– теплота змочування.
Поверхневий
натяг на межі тверда поверхня – повітря
 )завжди
більший, ніж на межі тверда поверхня –
рідина
)завжди
більший, ніж на межі тверда поверхня –
рідина
 )Ось
чому при змочуванні теплота виділяється.
)Ось
чому при змочуванні теплота виділяється.
Для гідрофільних поверхонь (приміром, амфіфільні * елементи) теплота змочування водою більша, ніж органічними рідинами. Для гідрофобних поверхонь ( друковальні елементи) спостерігається зворотна залежність.
Питому
поверхню ( член
в
рівнянні (4-18)) не завжди вдається виміряти.
Аби виключити величину
з
рівняння (4-18), можна визначити теплоту
змочування порошкової речовини абп
твердого тіла водою
 і досліджуватаним рідким вуглеводнем
( олією)
і досліджуватаним рідким вуглеводнем
( олією)
 і знайти відношення цих двох величин.
і знайти відношення цих двох величин.

Веоичину В називають коефіцієнтом гідрофільності. Гідрофільні поверхні мають в>1, а гідрофобні - <1.
4.6. Розтікання
Якшо
на поверхню води або іншої рідини,
нанести краплю нерозчинної у ній рідини,
то вона иоже розтікатись по поверхні,
а може не розтікатись. Розтікання
пов’язане
з поверхневим натягом на трьох поверхнях
подвлу фаз: вода-повітря ,
вода-олійна крапля
,
вода-олійна крапля
 і крапля-повітря
і крапля-повітря
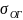 .
.
Довільно перебігають, як ми знаємо, процеси зі зменшенням поверхневої енергії Гіббса.
Припустимо,
що:
 (4.20)
(4.20)
У цьому випадку розтікання не відбувається, а сили тяжіння надають краплі сферичного вигляду (рис.4.12а)
Якщо ж співвідношення величин поверхневого натягу буде іншим:

То для зменшення поверхневої енергії повинен перебігати процес скорочення поділу повітря-вода і збільшення поверхні поділу вода-олія (крапля) і крапля повітря.
Крапля розтікатиметься поверхнею води і набуватиме вігляду лінзи ( рис.4.12.б.)
4.12б.
Мірою розтікання є коефіцієнт розтікання f:
 (4.22)
(4.22)
Тобто f – це зміна енергії Гіббса на одиниці плoщі поверхні в процесі розтікання. З іншого боку:
 (4.23)
(4.23)
Отже,
умови розтікання є такі : розтікання f
>0 ,
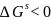 (4.24)
(4.24)
Відсутність
розтікання:
f
˂0 ,
 (4.25)
(4.25)
