
- •1. Сооружения, установки и аппараты для выделения из очищаемых сточных вод грубодисперсных примесей и взвесей.
- •3. Флокуляционная очистка загрязненных жидкостей.
- •4. Технология коагуляционной и флокуляционной очистки сточных вод и используемое оборудование.
- •5. Флотационная очистка загрязненных жидкостей.
- •Флотацион.Камера горизонт.Типа
- •6. Методы пенной флотации, схемы реализации каждого метода и технические характеристики.
- •Флотацион.Камера горизонт.Типа
- •7. Основные методы, аппараты и установки для электрообработки сточных вод.
- •8. Аэробная и анаэробная биологическая очистка сточных вод. Сущность каждого способа. Влияние внешних факторов на протекание процессов биологической очистки.
- •9.Сооружения для биологической очистки сточных вод в искусственно созданных условиях.
- •10. Очистка промышленных газообразных выбросов от вредных паров и газообразных компонентов. Метод адсорбции.
- •11. Осветление воды фильтрованием: механизмы задерживания примесей, фильтрующие материалы. Основные виды фильтров с зернистой загрузкой для очистки природных и сточных вод.
- •12. Ионный обмен: сущность способа, природные и синтетические иониты. Технолог. Схемы ионообменной очистки природных и св и установки для их реализации.
- •14. Деструктивные методы очистки св: обраб-ка воды разл. Окислителями, жидкофазное окисление, электрохимическая деструкция. Аппаратурное оформление этих методов.
- •15. Обработка осадков сточных вод: оборудование и свойства осадков, основные способы утилизации осадков, основные процессы обработки осадков с применением для этого оборудования.
- •17. Рециклизация ценных компонентов из твердых промышленных и бытовых отходов: основные методы извлечения ценных компонентов и применяемое для этого оборудование.
- •18. Установки и аппараты для сухой очистки газов от пылевых частиц.
- •19. Установки и аппараты (скрубберы) для мокрой очистки газов от пылевых частиц.
- •20. Очистка промышленных газообразных выбросов от вредных паров и газообразных компонентов. Термический метод.
14. Деструктивные методы очистки св: обраб-ка воды разл. Окислителями, жидкофазное окисление, электрохимическая деструкция. Аппаратурное оформление этих методов.
Окисление
примесей СВ активным хлором.
Хлорирование
явл хим. (окислит.) способом обраб-ки СВ,
получив. в наст. вр. широкое распр-е. В
технологии очистки СВ хлори-е примен.
д/обеззараж-я очищ.СВ от патогенных
бактерий, вирусов и удаления из СВ
фенолов, цианидов и др.в-в, а тж д/борьбы
с биолог. обрастаниями на сооруж-ях. Для
хлорир-я СВ испол-ется гл.образом
элементар.хлор. Кр. того, примен. след.
хлорсодер. соед.: хлорная известь и др.
сыпучие хлорсодер. продукты. Хлорная
известь содержит ок.30-35 % актив.хлора, а
гипохлорит кальция 30-45 %. Сl2,НОСl
и ОСl образ.своб. актив. хлор, кот явл
основ. обеззаражив. в-вом. Хлорная известь
содержит: Са(ОСl)2,
Са(ОН)2,
Н2О
в разл.соотнош-ях. Окисление цианидов
гипохлоритами или Сl2
производят
только в щелоч. среде (рН≥10):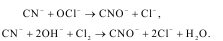
Образ.цианаты легко гидролизуются в воде или окисляются до элементарного азота и диоксида углерода:

Окисление
цианидов, а также сероводорода протекает
быстро (1-3 мин.). Образ.цианаты постоянно
гидролизуются. При понижении рН cреды
возможно протекание реакции прямого
хлорирования цианида с образ. токс.
хлорциана:
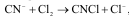 поэтому
очень важно при окислении цианидов
поддерживать щелочную среду. Хлор
обладает бактерицидной реакцией, кот.
носит физиолог. хар-р. Он вступает во
взаим. с протеинами и аминосоед-ями,
кот содержатся в оболочке бактерии и
ее внутриклет. в-ве. Рез-том таких
взаимод-й явл хим.изм-е внутриклет. в-ва,
распад структуры клетки и прекращение
жизнедеят-ти бактерий.
поэтому
очень важно при окислении цианидов
поддерживать щелочную среду. Хлор
обладает бактерицидной реакцией, кот.
носит физиолог. хар-р. Он вступает во
взаим. с протеинами и аминосоед-ями,
кот содержатся в оболочке бактерии и
ее внутриклет. в-ве. Рез-том таких
взаимод-й явл хим.изм-е внутриклет. в-ва,
распад структуры клетки и прекращение
жизнедеят-ти бактерий.
Окисление
примесей СВ активным диоксидом хлором.
Высокой
окислит. спос-тью. обладает СlО2.
Водные р-ры СlО2
относит.
устойчивы в течение длит. времени, при
обработке СВ диоксидом не образ. токс.х
продуктов прямого хлорир-я (хлорциана,
хлорфенола и др.) в любом диапазоне рН.
Окисление ционидов диоксидом хлора
протекает по уравнению:
![]()
и наиб.интенсивно идет в щелочной среде при рН≥10. До тех пор, пока концен. цианидов в р-ре остается выс., окисления до азота и диоксида углерода не происх.; цианаты начинают окисляться,когда остаточное содер. цианидов достигает 2,5-3 мг/л при дозе ClO2.
Окисление примесей СВ озоном.
Озонирование прим. д/очистки CВ от фенолов, нефтепродуктов, Н2S, соед-я мышьяка, ПАВ, и др. Обеззаражив. д-е О3 основано на высокой окислит. спос-тью, обуслов. легкостью отдачи им акт. атома О2. О3 значит. активнее хлора по отнош. к вирусам, т.к он действует непосред. на протоплазму клетки; под д-ем хлора бактерии отмирают постепенно, а при введении О3 практически мгновенно. О3 явл универс. реагентом,т.к. м.б. испол. д/обеззараж., обесцвеч., д/удаления Fe и Mn. О3 разрушает соед-я, не поддающиеся воздейст-ю хлора, не придает воде запаха и привкуса. Но при этом обладает сильными коррозион. свой-ми и кратковрем. д-ем. Поэтому все элементы озонаторных установок и трубопроводы, контактирующиеся О3 или его водными р-рами, д. изгот-тся из нержав.стали и Al, а после обеззараж. О3 воду хлорируют для образ-я в воде требуемого остаточного хлора. О3 подают в СВ в виде озоновоздушной или озоно-кислородной смеси. Конц-ция озона в смеси около 3 %. Д/усиления пр-са окисления смесь диспергируют в СВ на мельчайшие пузырьки газа. Озонирование пр.с. процесс абсорбции, сопровождаемой хим.реакцией в жидкой фазе:
О зонирование
воды- достат. сложный процесс, треб.
объед-я в одной установке устройств для
компрессирования и кондиционир.воздуха,
получения О3,
смешения его с водой, рекуперации или
разложения непрореагировавшего О3.
зонирование
воды- достат. сложный процесс, треб.
объед-я в одной установке устройств для
компрессирования и кондиционир.воздуха,
получения О3,
смешения его с водой, рекуперации или
разложения непрореагировавшего О3.
Принцип. технолог. схема озонирования состоит из 2-хоснов.узлов: получения О3 и очистки СВ. АВ подают на фильтр, где он очищается от пыли, после чего воздуходувками направ. на охлаж.устр-во для отделения капельной влаги, а затем осушается на адсорбционных установках. Осушка воздуха явл.одним из основ.этапов его подготовки перед получением О3 и осущест-ся в 2ступени. На 1-ой происх. предварит. охлаждение воздуха до 7-8 оС в холод. установке рассолом, подаваемым от фреоновой холод.установки. На 2-ой воздух сушат в адсорберах с алюмо-гелиевой или силикагельной насадкой. Осушенный воздух подвергается тонкой очистке от пыли, а затем направ. в озонатор.
В обрабат.воду О3 вводят разл.способами: барботированием воздушно-озоновой смеси в слое воды ч/фильтросные пластины или пористые трубки; смешением воды с озоновоздушной смесью в эжекторах или механ. роторных смесителях, в абсорберах различ.конструкций. Время контакта 5-20 мин. Эффек.озонир-я завис от кол-ва и св-в загряз.воду в-в, т-ры и рН среды, от дозы О3 и метода его диспергирования.
Окисление примесей воды О2. Схема установки для реализации метода
Для окисления сульфидных СВ целлюлозных, нефтеперераб. и нефтехим. заводов тж прим.О2. Реакция окисления идет в жидк. фазе при повыш.тем-ре и давлении.
Принцип.схема установки по окисл-ю сульфидов, содерж-хся в СВ, О2 воздуха: СВ поступ.в приемный резервуар и ч/теплообменник подается в окислит. колонну, а воздух- в нижн. часть колонны. Влага из отработ. воздуха конденсир. в сепараторе, откуда направ. в приемный резервуар. СВ после окисления охлаж. в холодильнике и поступают на дальн. очистку. Необработанная СВ подогревается водяным паром и теплотойконденсата.
Окисление примесей воды перексидом водорода.
П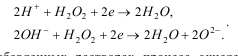 ероксид
водорода испол. для окисления нитритов,
альдегидов, фенолов, цианидов и др.
Пероксид водорода в кислой и щелочной
средах разлагается по след.схемам:
ероксид
водорода испол. для окисления нитритов,
альдегидов, фенолов, цианидов и др.
Пероксид водорода в кислой и щелочной
средах разлагается по след.схемам:
В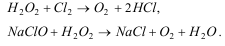 разбавл. растворах процесс окисления
орг. в-в протекает медленно, поэтому
испол-ся катализаторы- ионы металлов
перемен. валентности (Fe2+,
Cu2+,
Mn2+,
CO2+,
Cr2+,
Ag2+).
В пр-сах водообраб-ки испол-ются тж
восстановит. св-ва пероксида водорода.
В нейтр. и слабощелочной средах он легко
взаимод-ет с хлором и гипохлоритами,
переводя их в хлориды: эти реакции
используют при дехлорировании воды.
разбавл. растворах процесс окисления
орг. в-в протекает медленно, поэтому
испол-ся катализаторы- ионы металлов
перемен. валентности (Fe2+,
Cu2+,
Mn2+,
CO2+,
Cr2+,
Ag2+).
В пр-сах водообраб-ки испол-ются тж
восстановит. св-ва пероксида водорода.
В нейтр. и слабощелочной средах он легко
взаимод-ет с хлором и гипохлоритами,
переводя их в хлориды: эти реакции
используют при дехлорировании воды.
Метод жидкофазного окисления: сущность метода, условия реализации.
Метод жидкофазн. обезвреж-я СВ (мокрого сжигания) сост. в окислении О2 воздуха орг.примесей СВ при t-ре 100-350оС и давлении, обеспеч-е нахождение воды в жидк.фазе. При выс. давлениях раствор. в воде О2 значит. возрастает, что спос-ет ускорению пр-са окисл-я орг.в-в. В завис-ти от t-ры и времени контакта окисление орг. примесей происх. полностью или частично. В-ва,летучие при усл-ях пр-са, окисляются в основ. в парогазовой фазе, а нелетучие- в жидкой. Скорость реакций окисления растет с увелич. t-ры. Конечн. продукты жидкофазного окисл-я имеют выс. t-ру и давление и, след-но, обладают больш. энергией, кот. м. испол-ть д/выраб-ки эл.энергии и пара.
Электрохимическая деструкция. Сущность метода электрохим. деструкции заключ. в обраб-ке СВ в аппарате с нераствор-ми в усл-ях анодной поляризации электродами. Д/успешн. осущ-я электролиза необх. наличие в воде хлорид-ионов, соответ. подбор анодного мат-ла и опред. режимн. пар-ры обраб-ки. Пр-сы эл/хим. очистки воды всегда протекают с образ. газ. фазы. При наложении внеш.электрич.поля на катоде происх.выделение водорода и электролитическое восстанов.органич.соединений.
