
Лекция №5
ВОЗНИКНОВЕНИЕ И СТРУКТУРА ДВОЙНОГО ЭЛЕКТРИЧЕСКОГО СЛОЯ.
План лекции:
1.Двойной электрический слой.
2.Поверхностная энергия и заряд поверхности.
3.Возникновение двойного электрического слоя (ДЭС).
4.Модели ДЭС Гельмгольца, Гуи-Чепмена, Штерна.
5Специфическая адсорбция. Перезарядка.
6.Мицелла. Суспензионный эффект.
На поверхности твердого тела при его контакте с жидкостью самопроизвольно возникает избыточный электрический заряд, который компенсируется противоионами. В результате, на границе Ж-Т возникает ДЭС. Образование ДЭС происходит самопроизвольно, вследствие стремления поверхностной энергии к минимуму и в связи с особыми свойствами границы раздела.
Возникновение на границе электрических зарядов характерно, прежде всего, для золей и суспензий, дисперсная фаза которых формируется из твердых частиц.
При погружении металла в раствор электролита, содержащего ионы этого металла, устанавливается электрохимическое равновесие. Если химический потенциал ионов металла М больше химического потенциала этих же ионов в растворе р, то ионы переходят из металла в раствор, и поверхность металла заряжается отрицательно. И, наоборот, при помещении, например, медной пластинки в раствор сульфата меди с достаточно высокой концентрацией соли, металлическая поверхность заряжается положительно.
Возникновение зарядов на твердом теле приводит к тому, что на границе раздела фаз возникает электрический потенциал, обозначаемый через .
Если -потенциал определяется активностью ионов в растворе, то есть твердое тело играет роль электрода, то для выражения его можно воспользоваться уравнением Нернста:
![]()
![]() , (5.1)
, (5.1)
где n- заряд иона, F - число Фарадея, ап и ар -активности ионов у поверхности и в растворе.
ОБРАЗОВАНИЕ ДВОЙНОГО ЭЛЕТРИЧЕСКОГО СЛОЯ (ДЭС).
Поверхность твердого тела приобретает ионы определенного знака. Эти ионы называют потенциалоопределяющими. К твердой поверхности из жидкой среды притягиваются ионы противоположного знака, их называют противоионами. Возникает ДЭС.
Было предложено несколько теорий образования ДЭС.
Простейшей из них является модель плоского конденсатора Гельмгольца (5.1.а), согласно которой потенциалоопределяющие ионы и противоионы находятся на молекулярном расстоянии друг от друга, взаимодействие между ними осуществляется только за счет электростатических сил, а падение потенциала между слоями происходит линейно.
- + - + - +
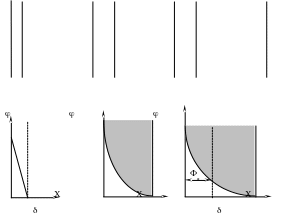
- + - + + - + +
+ +
- + - + - +
+ +
- + - +
а б в
Рис.5.1.
Дальнейшее развитие теория ДЭС получила в работах Гуи и Чепмена на основе сопоставления электростатического взаимодействия противоионов с энергией их теплового движения. Согласно модели Гуи и Чепмена противоионы рассматриваются как точечные заряды, не имеющие собственных размеров, расположенные в диффузном слое (5.1.б), а потенциал экспотенциально снижается по мере удаления от поверхности.
Согласно теории Штерна, которую можно рассматривать как основу современного представления о структуре ДЭС (5.1.в), противоионы находятся в двух положениях: одна их часть образует адсорбционный слой (иногда его называют плотным слоем или слоем Гельмгольца). Другая часть противоионов находится в диффузном слое. В отличие от адсорбционного слоя противоионы диффузного слоя не закреплены, в результате диффузии и взаимного отталкивания они способны перемещаться в пределах диффузного слоя в глубь жидкости.
ДЭС может возникнуть на частицах, находящихся в полярной среде, и в отсутствии электролитов, вследствие ориентации диполей, а также частичной поверхностной диссоциации полярных частиц, если в жидкой среде присутствуют хотя бы следы воды.
Потенциал, возникающий на границе между адсорбционным и диффузным слоем, называется потенциалом диффузного слоя д.
Толщина адсорбционного слоя определяется размерами противоионов, обычно она незначительна и не превышает 1 нм. В диффузном слое противоионы движутся хаотично, их положение изменяется. По этой причине толщина диффузного слоя будет величиной приведенной -.
Механизмы образования дэс.
Поверхностная ионизация.
ДЭС образуется, например, на поверхности между водой и малорастворимым AgI. При растворении AgI в воду переходят Ag+, так как они сильнее гидратируются, чем ионы I-. В результате поверхность иодида серебра будет иметь избыток I- (потнциалоопределяющие), которые нейтрализуются избытком Ag+ в водном слое (противоионы). Если в воду добавить AgNO3 (хорошо растворимый), то это приведет к увеличению электрохимического потенциала ионов серебра. С поверхности AgI в воду будут переходить ионы I- и поверхность соли заряжается положительно, противоионами будут ионы I-.
Преимущественный переход тех или иных ионов с поверхности вещества в раствор количественно можно характеризовать изоэлектрической точкой (ИЭТ).
ИЭТ+ = -lgc+ ИЭТ- = -lgc-
ИЭТ – отрицательный логарифм концентрации потенциалопределяющего иона, при которой электрический заряд на поверхности равен нулю.
ИЭТ связана с произведением растворимости (ПР):
ПР = с+ + с-, lgПР = +lgc+ + -lgc-
рПР = -lgПР = -(+lgc+ + -lgc-) = +lgc+ + -lgc-.
Электрический заряд поверхности AgI в водном растворе равен нулю при концентрации I- = 10-10,6М, ПРAgI = 10-16.
lgПР
= lgc+
+ lgc-
= lgc+c-,
ПР = с+с-,
то есть [Ag+]
=
![]()
или ИЭТAg+ = 5,4 ИЭТI- = 10,6.
Значения ИЭТ характеризуют различие в стремлении ионов перйти в раствор. Оно выражено сильнее у ионов серебра. Если потенциалопределяющие ионы Н+ или ОН-, то изоэлектрическая точка определяется значением рН.
Адсорбционный.
Адсорбционный механизм образования ДЭС наблюдается при адсорбции ионов в межфазном слое электролитов, не входящих в состав вещества. Например,, при добавлении в систему Ме – вода раствора NaCl приводит к адсорбции хлорид ионов на поверхности металла. На поверхности металла при этом появляется отрицательный заряд, а близлежащий слой раствора заряжается положительно.
При адсорбции в той же системе поверхностно активных веществ, диссоциирующих на ионы, на поверхности металла адсорбируются органические ионы, противоионы формируют ДЭС со стороны водной фазы, так сильнее с ней взаимодействуют.
Ориентационное.
ДЭС возникает в результате ориентирования полярных молекул.
ТЕРМОДИНАМИЧЕСКИЕ СООТНОШЕНИЯ МЕЖДУ ПОВЕРХНОСТНЫМ НАТЯЖЕНИЕМ И ЭЛЕКТРИЧЕСКИМ ПОТЕНЦИАЛОМ ДВОЙНОГО ЭЛЕКТРИЧЕСКОГО СЛОЯ..
Образование ДЭС происходит самопроизвольно, в результате стремления
системы уменьшить энергию Гиббса поверхностного слоя.
Обозначим изменение электрической энергии через dq ( - электрический потенциал ДЭС, q - заряд поверхности).
Тогда , в соответствии с обобщенным уравнением первого и второго начал термодинамики (без учета химической энергии), изменение энергии Гиббса на поверхности можно записать следующим образом:
dG = - S dT + dS + dq (5.2)
dS - изменение поверхностной энергии
При Т=const =>
dG = dS + dq (5.3)
Полный дифференциал энергии Гиббса :
dG = dS +S d + dq +q d
Вычитая это уравнение из (5.3), получим:
S d + q d = 0 (5.4)
Разделим (5.4) на S (площадь межфазной поверхности) и обозначим q/S через qS (плотность заряда) , получим выражение, называемое 1 уравнением Липпмана:
![]() (5.5)
(5.5)
Если знаки потенциала и заряда совпадают, то поверхностное натяжение уменьшается с увеличением потенциала, если их знаки противоположны, то с увеличением потенциала увеличивается поверхностное натяжение.
Дифференциальная емкость ДЭС , как и любого конденсатора, определяется соотношением:
![]() (5.6)
(5.6)
Дифференцируем (5.5) по и подставляем в полученное выражение соотношение (5.6), получаем второе уравнение Липпмана:
![]() (5.7)
(5.7)
