
Основные механизмы катализа.
Существуют 3 механизма:
1)окислительно-восстановительный – это процессы, обусловленные переносом электрона: окисление, восстановление, гидрирование и де-. Катализаторы этих процессов: переходные металлы (d, f-элементы) и их соединения; простые оксиды (оксиды ванадия V2O5, MnO2, MgO3, Cr2O3); более сложные оксиды (Fe3O4, FeO, Fe2O3); сульфиды (MoS2, WS2); комплексные соединения и соли.
Высокая каталитическая активность этих веществ объясняется тем, что эти элементы могут существовать в различных степенях окисления и переходы электронов не требуют больших затрат энергии.
2)кислотно-основной катализ – процессы каталитического крекинга, гидратация, полимеризация. Катализаторы – вещества, которые способны передать или принять протон от реагентов или способные к гетеролитическому взаимодействию с реагентами. Среди этих веществ наиболее часто применяются: кислоты Бренстеда H2SO4, H3PO4, HF, H2CO3; кислоты Льюиса AlCl3, FeCl3, BF3; вещества основного характера NaO, CaO, MgO.
3)ферментативный катализ. Биологические катализаторы, ускоряющие скорость реакции, называются ферментами. Принципиальное отличие ферментов от катализаторов других типов связано с высокой специфичностью, выходом целевого продукта 100%.
Технологические характеристики твердого катализатора.
Эффективность использования катализаторов в промышленности зависит от их технологических характеристик: активности, температуры зажигания, селективности, механической прочности, теплопроводности, пористости, устойчивости к ядам, доступностью и дешевизной.
1)Активностью катализатора называется мера ускоряющего воздействия по отношению к данной реакции (отношение констант скоростей каталитической и некаталитической реакций).
Снижая энергию активации, катализатор ускоряет ее на много порядков.
Продолжительность работы катализатора можно условно разделить на три периода:
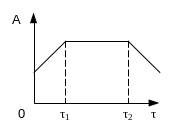
1)активация или разработка катализатора (Оτ1), на которой происходит окончательное формирование физико-химических свойств, а иногда и химического состава продукта. Обычно активация проводится путем постепенного разогрева катализатора до температуры реакции в потоке воздуха, газа или воды без реагирующих веществ или в их присутствии. Режим активации подбирается эмпирически.
2)постоянная активность – рабочий, стационарный период работы;
3)прогрессирующая дезактивация, связанная с изменением структуры поверхности катализатора.
Старение – естественный процесс, при котором активность уменьшается равномерно по всему слою катализатора. Утомление – неравномерное падение активности в слое катализатора – опасный процесс, проявляется задолго до истечения срока жизни катализатора в результате неправильной эксплуатации.
2)Температура зажигания катализатора – это та температура, при которой процесс начинает идти с достаточной для промышленных процессов скоростью, обеспечивая заданную производительность. Чем выше активность катализатора, тем ниже температура его зажигания.
Понятие «зажигание» означает, что при возрастании температуры выше предельной, равной Тз, происходит резкое, скачкообразное увеличение скорости реакции. Может иметь место и в некаталитических процессах.
С технологической точки зрения лучше использовать катализаторы с низкой температурой зажигания, что позволяет снизить энергетические затраты на предварительный нагрев реакционной смеси.
3)Селективностью или избирательностью катализатора называют его способность избирательно ускорять целевую реакцию при наличии нескольких побочных. На селективность влияют многие факторы. Прежде всего, - число координационных мест у активного атома поверхности, минимальное количество атомов поверхности, необходимых для образования связей с молекулой реагента, прочность этих связей, т.е. структура поверхности. Следующей группой факторов могут стать природа и структура носителей, а также происхождение сырья. Промышленный катализатор должен отличаться достаточной гибкостью и перерабатывать широкий ассортимент сырья без потери селективности.
4)Пористая и кристаллическая структура катализатора.
Важным свойством катализатора является его пористая структура, которая характеризуется размерами и формой пор, пористостью (отношением свободного объема пор к общему объему), удельной поверхностью катализатора (т.е. приходящейся на единицу массы или объема).
При выборе твердого вещества, которое должно служить активным катализатором для гетерогенных газовых реакций, важную роль играет доступность поверхности катализатора для реагирующих газов. Чем больше для каждого данного катализатора поверхность, доступная для реагирующего газа, тем выше скорость расходования реагентов в единицу времени при использовании того же количества катализатора.
Промышленные катализаторы всегда имеют развитую внутреннюю поверхность, иначе внешняя поверхность, весьма небольшая, быстро подвергалась бы отравлению, и катализатор вскоре утрачивал бы активность. Чем выше пористость катализатора и чем меньше диаметр пор, тем больше внутренняя поверхность. Современные катализаторы характеризуются большими значениями удельной поверхности (до 10- 100 м2/г).
В качестве катализаторов стараются применять природные или искусственные высокопористые адсорбенты (алюмосиликаты, цеолиты, силикагель, активированный уголь и т.д.). Эти вещества употребляют как носители, на поверхность которых наносят активные компоненты.
Наряду с пористой структурой большое значение имеет кристаллическая структура катализатора. Различные кристаллические модификации одного и того же вещества могут обладать сильно отличающейся каталитической активностью.
5)Промотирование и отравление катализаторов.
Отравлением катализатора каталитическими ядами называют частичную или полную потерю его активности под воздействием контактных ядов. Введение небольшого количества посторонней добавки к основному катализатору приводит к резкому повышению его активности или снижению активности на несколько порядков. В первом случае говорят о промотировании, во втором – об отравлении катализатора.
Отравление бывает обратимым и необратимым. При обратимом отравлении активность катализатора постепенно восстанавливается, если в реакционной смеси больше не содержится каталитического яда. При необратимом отравлении действием свежей реакционной смеси активность восстановить не удается. Одно и то же вещество может вызвать и обратимое и необратимое отравление, в зависимости от продолжительности его действия, концентрации в реакционной смеси, температуры процесса.
Для удлинения срока службы катализатора в промышленных условиях предусматривают тщательную очистку реагирующих веществ от примесей, являющихся каталитическими ядами. Катализатор отравляется иногда побочными продуктами реакции. В реакциях органических соединений (крекинга, дегидрирования, изомеризации) отравление катализаторов часто происходит в результате образования высокоуглеродистой полимерной пленки (кокса), покрывающей поверхность катализатора. Для ее удаления цикл катализа сменяют циклом регенерации – катализатор продувают при высокой температуре воздухом для перевода кокса в СО2.
