
Равновесие химических реакций.
Для химических реакций равновесным считается состояние, в которое приходит система при постоянных внешних условиях, характеризуемое неизменностью во времени термодинамических параметров и отсутствием в системе потока вещества и теплоты.
Устойчивое равновесие характеризуется:
1)неизменностью во времени при постоянных внешних условиях;
2)подвижностью равновесия – самопроизвольным восстановлением равновесия после снятия внешнего воздействия;
3)динамическим характером – равенство скоростей прямой и обратной реакций;
4)возможностью подхода к равновесию с двух противоположных сторон;
5)минимальным значением энергии Гиббса dG=0 в изобарно-изотермических процессах и минимальным значением энергии Гельмгольца dF=0 в изохорно-изотермических процессах;
6)неизменностью числа молекул для определенной системы при неизменных внешних условиях.
Закон действующих масс.
Впервые зависимость направления химического процесса от концентрации реагирующих веществ установил Н.Н. Бекетов в 1865 г. на основании экспериментов. В математической форме закон был сформулирован Гульдбергом и Вааге в 1867 г.
Рассмотрим кинетический вывод закона действующих масс на примере гомогенной реакции:
![]()
Как известно, скорость прямой реакции пропорциональна произведению концентраций реагентов А и В:
![]()
а скорость обратной реакции – произведению концентраций продуктов R и S:
![]()
Каждая концентрация возведена в степень, равную стехиометрическому коэффициенту компонента в химическом уравнении. Из условия равенства скоростей прямой и обратной реакций в момент равновесия получаем
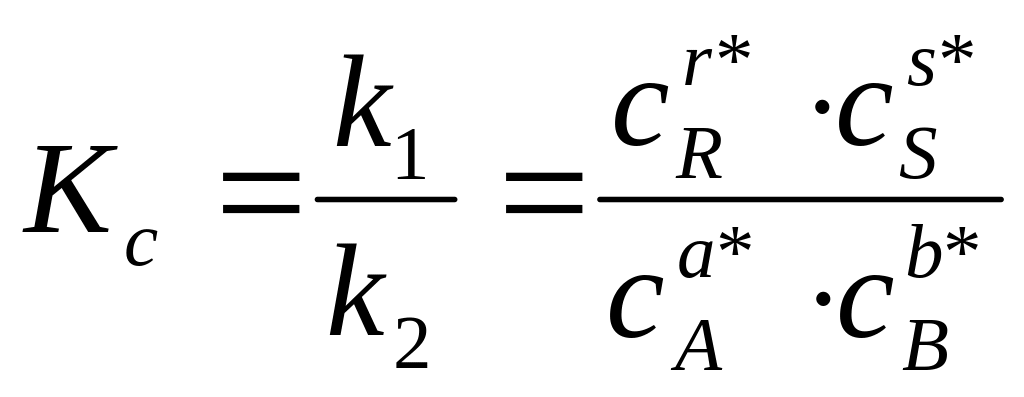
где с – равновесные концентрации.
Отношение констант скоростей, называемое константой равновесия, выражает закон действующих масс:
Изменение концентрации одного из участников реакции вызовет такие изменения концентрации всех остальных таким образом, что Кс сохранит свое числовое значение при неизменности Т и р.
При анализе реакций, протекающих в газовой фазе, константу равновесия выражают через парциальное давление:
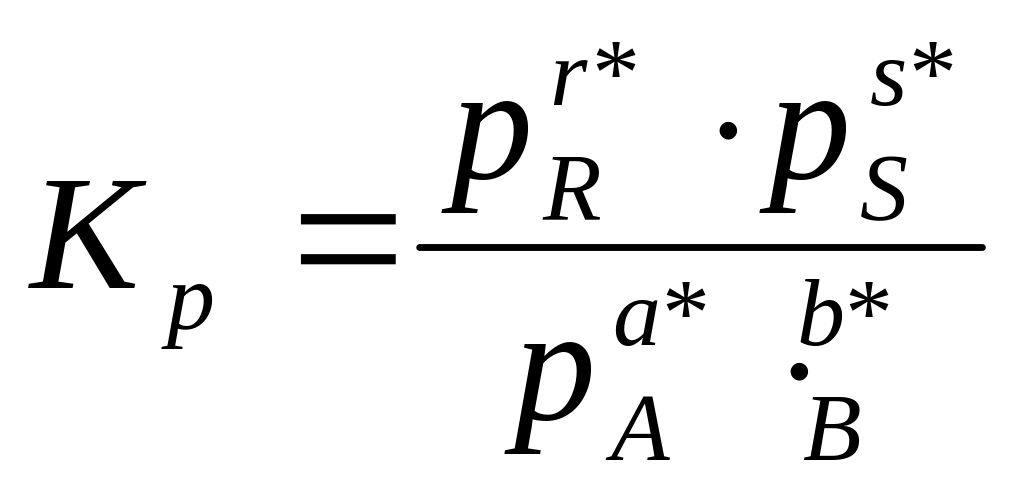
Так
как в соответствии с уравнением
Менделеева−Клапейрона
![]()
где Δn=(r+s-a-b), если все участники реакции – газообразные вещества.
Константа равновесия может быть выражена через молярные концентрации участников Кс, их парциальные давления Кр или их молярные доли КN.
Катализ в промышленности.
С точки зрения совершенства ХТП, катализаторы играют одну из наиболее важных ролей. Катализатор влияет на экономические и экологические показатели процесса.
Катализаторы – это вещества, которые, многократно вступая в промежуточное взаимодействие с участниками реакции, изменяют ее механизм и увеличивают скорость реакции, при этом они восстанавливают свой химический состав после каждого цикла промежуточных взаимодействий. Катализаторами могут быть элементарные вещества (металлы, активированный уголь), химические соединения (оксиды, сульфиды, хлориды), сложные комплексы и многоатомные молекулы, их смеси. Специфичность катализатора зависит как от его состава и строения, так и от вида химической реакции.
В промышленности наиболее распространен гетерогенный катализ: катализаторами являются вещества в твердом состоянии, в виде мелкодисперсных частиц для процессов в «кипящем» слое и в виде гранул различной формы для процессов в стационарном слое катализатора. Реагенты для процессов могут быть в газообразной либо в жидкой форме.
Определенную роль в промышленных процессах играет и гомогенный катализ. Чаще всего это процессы, протекающие в жидкой фазе: в определенный растворитель подается катализатор либо компонент каталитического комплекса, и подаются реагенты, которые имеют определенную растворимость в данном растворителе. Взаимодействие реагентов происходит в жидкой фазе.
Гомогенный катализ не получил столь широкого распространения, как гетерогенный, из-за трудности отделения конечного продукта от катализатора.
