
Зависимость скорости химических реакций от концентрации реагентов. Кинетические уравнения.
Законы химической кинетики основаны на двух постулатах, впервые установленных при изучении реакций в растворах:
1)скорость химической реакции пропорциональна концентрациям реагентов;
2)суммарная скорость нескольких последовательных превращений, различающихся по скорости, определяется скоростью наиболее медленной стадии.
В настоящее время в кинетике реакции делятся на простые, формально простые и сложные. Простыми называются реакции, осуществление которых связано с преодолением одного энергетического барьера при переходе из одного состояния реакционной системы в другое.
Кинетическое уравнение необратимой элементарной реакции
![]()
в соответствии с первым постулатом, основанном на законе действующих масс, имеет вид
![]()
Коэффициент пропорциональности к, входящий в кинетическое уравнение, называется константой скорости. Константа скорости не зависит от концентрации реагирующих веществ. Величина константы скорости зависит от природы реагирующих веществ, температуры и присутствия катализатора. Числовое значение константы скорости равно количеству вещества, прореагировавшего за единицу времени при концентрации исходных веществ, равных единице. Наиболее распространенными типами сложных реакций являются параллельные и последовательные реакции. Если протекает многостадийная реакция, то скорость реакции по одному из участников определяется, как алгебраическая сумма скоростей тех стадий, в которых этот реагент принимает участие. Если реагент расходуется (является реагентом), то записывается в общей сумме со знаком «+». Те стадии, в которых он образуется (является продуктом), записываются со знаком «−».
Скорость химического превращения зависит от большого числа переменных. На скорость влияют не только факторы, определяющие состояние химического процесса (Т, р, состав реакционной смеси), но и наличие или отсутствие посторонних веществ, не претерпевающих изменений в результате реакций, условия физической транспортировки реагентов к реакционным центрам и др.
Влияние температуры на скорость реакций. Энергия активации. Влияние температуры на скорость реакции выявил Вант-Гофф экспериментально. Было обнаружено, что при увеличении температуры на 10 градусов скорость реакции возрастает в 2-4 раза.
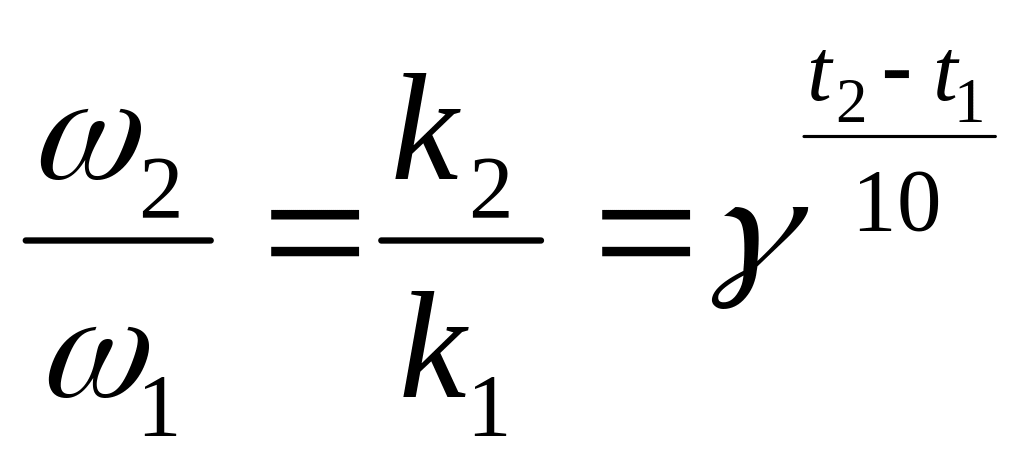
γ – температурный коэффициент реакции, показывает, во сколько раз увеличится скорость реакции при повышении температуры на 10 градусов.
Более точно влияние температуры на константу скорости установил Аррениус:
![]()
где к – константа скорости реакции; к0 – предэкспоненциальный множитель; Е – энергия активации реакции; R – универсальная газовая постоянная; Т – температура.
Энергия активации элементарной реакции Е – энергетический барьер, который должны преодолеть молекулы при переходе из одного состояния реакционной системы в другое.
Предэкспоненциальный множитель к0 учитывает число соударений, вероятность распада активированного комплекса реакции на исходные реагенты без образования продуктов реакции, пространственную ориентацию молекул реагентов, а также ряд других факторов, влияющих на скорость реакции и не зависящих от температуры.
Графически уравнение Аррениуса представляют в виде линейной зависимости логарифма константы скорости от обратной температуры: ln k = f (1/T).
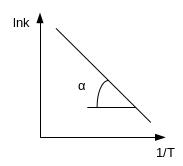
Чем выше энергия активации реакции, тем более чувствительна она к изменениям температуры. Если энергия активации целевой реакции превышает энергию активации побочной реакции, то с ростом температуры наблюдается более быстрое увеличение скорости целевой реакции по сравнению с увеличением скорости побочной реакции и суммарной скорости процесса. В противном случае, для увеличения селективности нужно понижать, а не повышать температуру.
