
Лекция 2. Строение атома и систематика химических элементов.
2.1 Квантово - механическая модель атома
Современные квантово - механические представления о строении электронной оболочки атома исходят из того, что движение электрона в атоме нельзя описать определенной траекторией.
В 1924 г. Луи де Бройлъ выдвинул гипотезу (которая позднее была подтверждена экспериментально) о том, что микрочастицы обладают волновыми свойствами.
Поскольку электрон обладает одновременно свойствами частицы и волны, то невозможно одновременно и абсолютно точно определить импульс и местоположения электрона. Неточность таких определений постулируется как принцип неопределенности (Гейзенберг, 1927г.). Отсюда следует важный вывод: если нельзя точно найти координату и импульс электрона, то нельзя точно описать размеры и форму его орбиты, а также размеры и форму атома. Все, что можно сказать о положении электрона в атоме - это вероятность его нахождения в какой-либо области пространства вблизи ядра.
Вероятность
положения электрона обычно выражают
квадратом волновой
функции
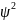 .
Физический смысл
.
Физический смысл
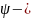 функции - вероятность нахождения
электрона в некотором объеме пространства
вокруг ядра пропорциональна
квадрату функции
.
функции - вероятность нахождения
электрона в некотором объеме пространства
вокруг ядра пропорциональна
квадрату функции
.
Вероятность нахождения электрона в сферическом слое между двумя сферами, имеющими радиусы r и (r+dr) равна:
d
=
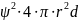
Вероятность нахождения электрона в зависимости от расстояния r ядро – электрон может быть представлена графически (рис 1):
4
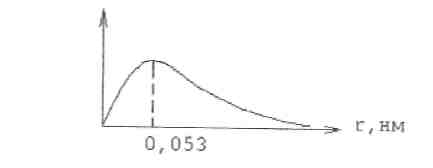
Рис.1 Распределение вероятности нахождения электрона
в пространстве около ядра.
Такое
распределение вероятности следует
понимать так, что на любом побранном
расстоянии от ядра вероятность пребывания
электрона одинакова во всех направлениях
радиус-вектора. Как следует из рис.1,
вероятность пребывания электрона в
атомном ядре равна нулю, она незначительна
вблизи ядра, но на некотором расстоянии
 нм
вероятность достигает максимума, а
затем медленно уменьшается (асимптотически
приближается к нулю). Т.е. невозможно
без дополнительных условий указать
размеры атома.
нм
вероятность достигает максимума, а
затем медленно уменьшается (асимптотически
приближается к нулю). Т.е. невозможно
без дополнительных условий указать
размеры атома.
Совокупность мест пространства, где квадрат функции имеет максимальное значение, называется электронной орбиталью. Так как электрон несет отрицательный заряд, то его орбиталь представляет собой определенное распределение заряда, которое получило название (электронного облака). Область наибольшей вероятности (90-95%) нахождения электрона в атоме водорода показана на рис.2.
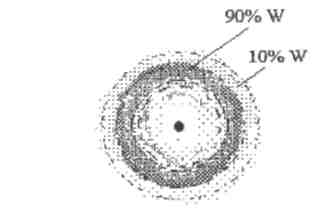
Рис.2 Графическое выделение орбитали
В атоме водорода.
Для
того, чтоб найти волновую функцию,
необходимо решить уравнение Шредингера,
которое связывает волновую функцию
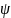 с потенциальной энергией электрона
Епот.
и его полной энергией Е. Исследование
решений уравнения Шредингера показало,
что величины, характеризующие состояние
электрона в атоме квантованы (изменяются
скачкообразно). Квантованы
энергия, момент импульса, угол наклона
плоскости орбиты в магнитном поле.
с потенциальной энергией электрона
Епот.
и его полной энергией Е. Исследование
решений уравнения Шредингера показало,
что величины, характеризующие состояние
электрона в атоме квантованы (изменяются
скачкообразно). Квантованы
энергия, момент импульса, угол наклона
плоскости орбиты в магнитном поле.
Квантовые числа. Состояние электрона в атоме можно охарактеризовать набором четырех квантовых чисел.
Главное
квантовое число n
определяет
энергию электрона и размер электронных
облаков. Принимает значения натурального
ряда чисел (1,2,...,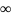 ).
).
Электроны могут занимать в атоме положения, которым отвечают только определенные (квантованные) энергетические состояния - энергетические уровни. Главное квантовое число n определяет расположение электронов на том или ином энергетическом уровне. Чем ближе к ядру находится электрон, тем меньше его энергия. Поэтому минимальной энергией он обладает, находясь на первом энергетическом уровне. На наиболее удаленном от ядра уровне энергия электрона максимальна.
При переходе электрона с дальнего уровня на ближний к ядру выделяются кванты энергии.
Каждому энергетическому уровню отвечает свой набор электронов (электронный слой или электронная оболочка). Энергетические уровни обозначают буквами или цифрами:

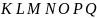
Орбитальное квантовое число l характеризует форму электронного облака. Движущийся электрон в зависимости от формы электронных облаков обладает определенным орбитальным моментом или моментом импульса L, определяемым по формуле:
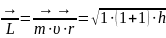
где l – орбитальное квантовое число
r – радиус-вектор.
Поскольку L может принимать только дискретные значения, задаваемые l, то и формы электронных облаков не могут быть произвольными. Каждому значению l соответствует определенная форма электронного облака.
Орбитальное квантовое число может иметь целочисленные значения от 0 до (n -1). Если n =1, то l =0, при этом электронное облако имеет форму шара. При n =2 орбитальное квантовое число имеет два значения: l=0, 1. Орбитальному квантовому числу l=1 соответствует гантелевидная форма электронного облака. При п=3 орбитальное квантовое число принимает значения l =0,1,2. Форма электронного облака при l =2 - четырехлепестковая розетка. Если п=4, то l =0,1,2,3. Орбитальному квантовому числу l =3 соответствует более сложная форма электронного облака (см. рис.3).
Электроны, характеризующиеся орбитальными квантовыми числами l =0,1,2,3 называют, соответственно –s, -p,-d,-f электронами.
Квантово-механические расчеты показывают, что в многоэлектронных атомах энергия электронов зависит не только от главного, но и от орбитального квантового числа. Каждый энергетический уровень, кроме первого, расщепляется на энергетические подуровни, они обозначаются буквами:
Орбитальное квантовое число l |
0
|
1
|
2 |
3 |
4 |
Обозначение подуровня |
s |
p |
d |
f |
g |
Второй
энергетический уровень расщепляется
на два подуровня 2s
и
2р;
третий
- на три подуровня 3s,
3p,
3d;
четвертый
- на подуровни 4s,
4p,
4d,
4f.
.
В
пределах одного и того же уровня энергия
подуровней возрастает в ряду
Es Ep
Ed
Ef.
Ep
Ed
Ef.
Магнитное квантовое число m. Из уравнения Шредингера следует, что ориентация электронных облаков в пространстве не может быть произвольной, она определяется значением третьего магнитного квантового числа ml.
В отсутствии внешнего магнитного поля все орбитали одного подуровня имеют одинаковые значения энергии. Под воздействием внешнего магнитного поля происходит расщепление энергии подуровней.
Магнитное квантовое число может принимать целочисленные значения в пределах от - l до + l, включая C. Число возможных значений ml равно (2 l +1).
Если l =0, то ml =0, значит, на s-подуровне имеется только одна орбиталь. Любые возможные расположения электронного облака s-электрона в пространстве идентичны.
При l =1, ml = -1, 0, +1, таким образом, на р-подуровне существует три орбитали. Электронные облаках р-электронов ориентированы в пространстве во взаимно перпендикулярных плоскостях.
При l =2, ml = -2, -1, 0, +1, +2, на d подуровне - пять орбиталей. Пространственная ориентация электронных облаков показана на рис.3
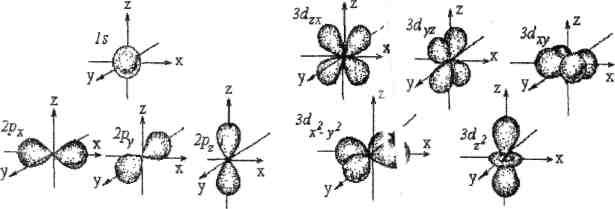
Рис.3. Форма и пространственная ориентация
элект ронных облаков s-,p-, d- электронов
Спиновое
квантовое число тs.
Три
квантовых числа не полностью
характеризуют состояние электрона в
атоме. Было обнаружено, что каждый
электрон обладает, кроме орбитального
магнитного момента, собственным
магнитным моментом, названным спином.
Величину
и ориентацию спина характеризует
спиновое квантовое число тs,
которое может принимать только два
значения +1/2
или -1/2.
Положительное и отрицательное значение
спина связано с его направлением по
отношению к полю. Спин электрона
условно обозначают стрелками:
Принцип Паули. Поведение электронов в атоме подчиняется принципу Паули (1925г.): в атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковы.
Следствия из принципа Паули:
максимальное число электронов на уровне равно удвоенному значению квадрата главного квантового числа: N=2n2 ;
максимальное число электронов в данном подуровне: М=2
 (2l+1),
где l
- орбитальное квантовое число.
(2l+1),
где l
- орбитальное квантовое число.
Пример.
l=3,
тогда
М = 2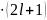 =
2
(2
3+1)
= 14, следовательно, на f-подуровне
может одновременно находиться максимум
14 электронов.
=
2
(2
3+1)
= 14, следовательно, на f-подуровне
может одновременно находиться максимум
14 электронов.
Атомные орбитали. Совокупность положений электрона в атоме, характеризуемых определенными значениями квантовых чисел n, l, ml называют атомной орбиталью (АО). Атомную орбиталь условно обозначают в виде квадрата, называемого квантовой ячейкой, а электрон - вертикальной стрелкой. На атомной орбитали может находиться не более двух электронов с противоположно направленными спинами.
АО характеризуется определенным энергетическим уровнем. На каждом энергетическом уровне в атоме имеется только одна s-орбиталь, максимально заселенная двумя электронами. На всех энергетических уровнях, кроме первого имеется три p-орбитали, которые могут быть максимально заселены шестью электронами. На третьем и последующих уровнях появляются пять d-орбиталей с максимальным заселением десятью электронами. А с четвертого и последующих уровнях - еще семь f-орбиталей с максимальным заселением 14 электронами.
Правило Хунда. Заполнение атомных орбиталей внутри одного энергетического подуровня происходит в соответствии с правилом Хунда (1927 г.): «Атомные орбитали, принадлежащие к одному подуровню, заполняются каждая вначале одним электроном, а затем - вторым электроном». Иными словами, при заполнении электронами подуровня суммарный спин (сумма спинов всех электронов, входящих в подуровень) должен быть максимальным.
Рассмотрим расположение четырех электронов на р-подуровне. Неправильное изображение Правильное изображение

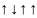
б)
В случае а) суммарный спин равен 0; в случае б) суммарный спин равен 1.
Взаимосвязь квантовых чисел, число атомных орбиталей и максимальное число электронов на уровнях и подуровнях в атоме показаны в таблице 1.
Таблица 1 – максимальная емкость энергетических уровней и подуровней.

Исследуя данные таблицы, можно прийти к двум выводам:
с ростом главного квантового числа n емкость энергетических уровней возрастает и для 1,2,3, 4-го уровней составляет 2, 8, 18, 32 электрона;
в каждом следующем вышестоящем уровне сохраняется электронная структура предыдущего уровня и прибавляется новый подуровень. Например, четвертый уровень имеет структуру третьего (s, p, d - подуровни) и добавляется новый f-подуровень.
