
Лекция 3. Химическая связь и строение молекул.
Образование химических соединений обусловлено возникновением химической связи между атомами в молекулах и кристаллах.
Различают три основных типа химической связи: ковалентную, ионную и металлическую. Эти типы химической связи не существуют изолированно друг от друга в реальных веществах, они являются только моделями различных форм химического связывания.
Для объяснения химической связи используются два подхода: метод валентных связей и метод молекулярных орбиталей.
3.1 Ковалентная связь
Образование ковалентной связи. Ковалентная связь образуется за счет общих электронных пар, возникающих в электронных оболочках связываемых атомов. Рассмотрим образование химической связи на примере взаимодействия атомов водорода.
По методу валентных связей: при сближении двух атомов водорода происходит перекрывание их s-атомных орбиталей, каждая из которых содержит один электрон. Такое взаимодействие возможно, когда электроны имеют антипараллельные спины. При перекрывании атомных орбиталей образуется повышенная электронная плотность в области между ядрами атомов, вследствие чего возрастают силы притяжения между атомами.
Процесс образования общей электронной пары сопровождается выделением энергии. Общая энергия системы понижается, и система становится более устойчивой. Минимальную энергию система имеет на некотором расстоянии между атомами. При дальнейшем сближении атомов начинают преобладать силы электростатического отталкивания между ядрами, и энергия системы снова возрастает (см. рис. 4).
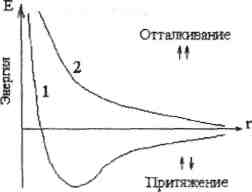
Рис.4 Зависимость энергии системы из двух атомов водорода с параллельными (1)
И антипараллельными (2) спинами от расстояния между ядрами.
Таким образом, при образовании ковалентной связи всегда выделяется энергия; она называется энергией связи; определяет прочность связи.
Для разрыва связи необходимо затратить энергию. Мерой прочности связи является количество энергии, необходимое для ее разрыва. Ковалентная связь тем прочнее, чем выше степень перекрывания электронных облаков, которая в свою очередь зависит от размера и формы электронных облаков.
По методу молекулярных орбиталей: орбитали двух атомов водорода при их достаточном сближении и перекрывании комбинируются в две молекулярные орбитали (МО), внутри которых располагаются оба атомных ядра.
Образовавшиеся молекулярные орбитали различаются по энергии. Молекулярная орбиталь, которая оказывается боле выгодной для электронов по энергии, благодаря которой атомы связываются в молекулу, называется связывающей. Другая молекулярная орбиталь, менее выгодная по энергии, чем исходные атомные орбитали, называется разрыхляющей. Связывающей МО отвечает повышенная электронная плотность в области между атомными ядрами.
Электроны на связывающей МО укрепляют химическую связь, а на разрыхляющей МО - ослабляют химическую связь. При образовании молекулы электроны вначале занимают связывающие молекулярные орбитали, а затем разрыхляющие молекулярные орбитали.
Оба электрона двух атомов водорода оказываются при образовании связи на единственной связывающей МО (см. рис. 5)
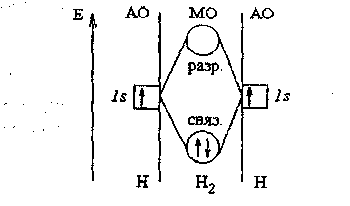
Рис.5. Энергетическая диаграмма образования связи в молекуле Н2.
Ковалентная связь между двумя атомами образуется тогда, когда действия хотя бы одной связывающей МО не компенсируется разрыхляющей МО.
Донорно-акцепторный механизм образования ковалентной связи. Ковалентная связь может образоваться не только за счет перекрывания атомных орбиталей, содержащих по одному электрону, но и за счет перекрывания заполненной атомной орбитали одного атома или иона и свободной орбитали другого атома или иона.
Атом или ион, поставляющий пару электронов, называют донором, а атом или ион, приобретающий часть электронной плотности - акцептором.
Рассмотрим образование ковалентной связи по донорно-акцептор-ному механизму при взаимодействии молекулы NH3 с ионом водорода Н+. Азот имеет 5 валентных электронов, из которых три неспаренных 2р-электрона образовали связи с электронами трех атомов водорода в молекуле NH3. Оставшаяся пара 2s-электронов азота взаимодействует с вакантной орбиталью иона водорода по донорно-акцепторному механизму с образованием катиона аммония NH+. Атом азота является донором, а ион водорода - акцептором.
Образование иона NH4 можно представить следующей схемой:

Насыщаемость ковалентной связи. В образовании ковалентных связей принимают участие неспаренные электроны.
Для наглядного изображения ковалентных связей в химических формулах используются точки (каждая точка отвечает валентному электрону). Связи в молекулах Cl2, H2O, NH3 можно изобразить так:
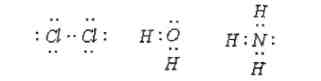
Возбуждение атомов требует затраты определенной энергии. Поэтому распаривание электронов возможно лишь в тех случаях, когда затраты энергии компенсируются энергией, выделяемой при образовании связей. Например, нормальное и возбужденное состояния атомов углерода и хлора:

В образовании химических связей принимают участие электроны только внешних энергетических уровней (валентные электроны), а это ограниченное число электронов, поэтому ковалентная связь имеет насыщаемость.
Валентность элемента - это способность его атомов соединяться с другими атомами. По методу валентных связей валентность определяется числом неспаренных электронов. Валентность углерода в нормальном состоянии равна 2, в возбужденном - 4. Хлор в нормальном состоянии одновалентен, в возбужденном валентность может быть равна 3, 5, 7. Число ковалентных связей, которые образует атом, называется ковалентностью.
Направленность ковалентной связи. Атомные орбитали (АО) имеют различную форму и определенную пространственную ориентацию. Соответственно и область перекрывания АО находится в определенном направлении по отношению к взаимодействующим атомам, поэтому ковалентная связь имеет направленность.
В
зависимости от направления перекрывания
АО различают
 -
и
-
и
 -связи.
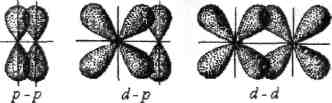
а-Связь возникает при перекрывании
атомных орбиталей вдоль оси, соединяющей
ядра взаимодействующих атомов,
-связь - результат прямого перекрывания
орбиталей; одна область перекрывания:
-связи.
а-Связь возникает при перекрывании
атомных орбиталей вдоль оси, соединяющей
ядра взаимодействующих атомов,
-связь - результат прямого перекрывания
орбиталей; одна область перекрывания:

-связь осуществляется при перекрывании атомных орбиталей по обе стороны от оси, соединяющей ядра атомов. -связь – результат бокового перекрывания орбиталей, две области перекрывания:
 связи
связи
при перекрывании атомных p-, d- орбиталей
Энергия --связи меньше, чем энергия -связи. -связь менее прочная, чем связь. Например, между атомами азота в молекуле азота образуется одна - и две -связи.
Гибридизация атомных орбиталей. Очень часто атом образует связи за счет электронов разных энергетических состояний. Например, у бериллия (Be), углерода (С) в образовании связи участвуют одновременно s- и p-электроны. В этом случае происходит гибридизация атомных орбиталей: первоначальная форма орбиталей взаимно изменяется и образуются новые орбитали одинаковой формы. Их называют гибридными. Форма гибридной орбитали асимметрична: она более вытянута в одну сторону от ядра, чем в другую. Химическая связь, образованная за счет участия гибридных орбиталей, должна быть более прочной, чем за счет отдельных s- и p-орбиталей. Таким образом, гибридизация связана с энергетическим выигрышем за счет образования более прочных связей и более симметричного распределения электронной плотности в молекуле.
По числу участвующих в гибридизации атомных орбиталей различают следующие, наиболее распространенные типы гибридизации:
sp-гибридизация. Смешение одной s- и p- орбитали приводит к возникновению двух гибридных орбиталей, расположенных относительно друг друга под углом 180° (см. рис. 8). Отсюда связи, образованные с их участием, располагаются под этим же углом. Форма молекулы линейная. Например, перекрывание sp-гибридных орбиталей атома бериллия с s-атомными орбиталями двух атомов водорода приведет к образованию линейной молекулы гидрида бериллия ВеН2
180°
![]()
Рис.8. Схема sp-гибридизации
sp2-гибридизация.
Взаимодействие одной s- и двух p-орбиталей приводит к образованию трех гибридных орбиталей, расположенных друг к другу под углом 120°. Под таким же углом располагаются связи, образованные с их участием. Форма молекулы треугольная.

Например, перекрывание sp2 -гибридных орбиталей атома алюминия (Al) с s-орбиталями трех атомов водорода приводит к образованию треугольной молекулы гидрида алюминия.
sp3гибридизация. Взаимодействие одной s- и трех p-орбиталей сопровождается sp3Лгибридизацией, при которой четыре гибридных орбитали направлены в вершины тетраэдра, под углом 109,5°.
s
+ 3p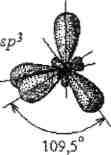

Рис.10. Схема sp3-гибридизации.
Например, при перекрывании sp3-гибридных орбиталей атома кремния (Si) с s-орбиталями четырех атомов водорода образуется тэтраэдрическая молекула силана SiH4. sp3-гибридизация может осуществляться и в тех случаях, когда центральный атом молекулы образует менее четырех связей, но имеет неподеленные электронные пары (в молекулах NH3, Н20).
Ковалентные связи с участием атома углерода. В основном состоянии атом углерода имеет два неспаренных электрона, за счет которых может образовывать только две общие электронные пары. Чтобы иметь возможность принять участие в образовании четырех общих электронных пар, атом углерода должен располагать четырьмя неспаренными электронами. Это достигается переводом атома углерода в возбужденное состояние, при переносе одного 2s-электрона на 2р-под-уровень

После возбуждения 2s- и 2р-АО углерода гибридизуются тремя различными способами: sp3 -гибридизация (тетраэдрическое расположение осей четырех гибридных АО); зр2-гибридизация (тригональное расположение осей трех гибридных АО); sp-гибридизация (линейное расположение осей двух гибридных АО)
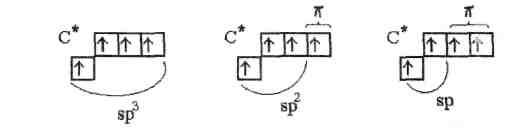
При sp2 - и sp-гибридизации только три или две АО углерода участвуют в образовании -связей. Оставшиеся АО углерода имеют возможность формировать - составляющие многократных связей углерод - углерод.
Неполярная и полярная ковалентная связь. Чисто ковалентные связи образуются между атомами одного и того же элемента (Сl2, Н2). Такая связь является неполярной, т.к. электронная плотность распределена симметрично между ядрами молекулы.
При
образовании молекулы атомами элементов,
имеющих различную электроотрицательность,
наблюдается асимметричное распределение
электронной плотности. Более
электроотрицательный атом в большей
степени притягивает электронную пару,
приобретая некоторый отрицательный
заряд -8 , а атом-партнер положительный
заряд +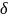 .
В этом случае молекула полярная.
.
В этом случае молекула полярная.
Молекула тем более полярна, чем больше смещена общая электронная пара к одному из атомов, чем больше разность значений ЭО элементов.
Количественной
мерой полярности связи служит также
электрический
момент диполя
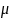 ,
представляющего
собой произведение длины диполя l
(расстояние между «центрами тяжести»
положительных И отрицательных
зарядов) на величину электрического
заряда q:
,
представляющего
собой произведение длины диполя l
(расстояние между «центрами тяжести»
положительных И отрицательных
зарядов) на величину электрического
заряда q:
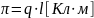
Полярность молекулы и полярность связи совпадают в двухатомных молекулах. В многоатомных молекулах полярность будет зависеть от полярности отдельных связей и их направленности. Электрический момент диполя является векторной величиной (направлен от положительного конца диполя к отрицательному). Тогда суммарный дипольный момент молекулы равен геометрической сумме электрических моментов диполей входящих в нее связей. Например, связь С-Н является полярной, а молекула СН4 - неполярна, вследствие взаимной компенсации ди-польных моментов связей. Напротив, в молекуле воды полярные связи Н-О располагаются под углом 104°30', электрические моменты диполей взаимно не компенсируются и молекула воды является полярной.
Задача. Какова пространственная структура молекулы С2Н4? К какому
виду относятся образовавшиеся связи?
Решение.
В молекуле этилена СrН4 атом углерода находится в состоянии sp2 -гибридизации. Две sp2-гибридные АО углерода перекрываются с двумя 1s-АО водорода, формируются две -связи С-Н. Третья sp2-гибридная орбиталь одного атома углерода и такая же орбиталь другого атома углерода образуют -составляющую, а негибридные р-орбитали тех же атомов - -составляющую двойной связи С=С.
Разделение двойной связи на - и составляющие условно, хотя вклад -составляющей в общую энергию двойной связи считается более высоким, чем -составляющей.
