
Лекция 4. Энергетика и направленность химических процессов.
Химические реакции сопровождаются разрывом старых связей и образованием новых связей. Происходящая при этом перестройка электронных структур атомов, молекул сопровождается превращением химической энергии в другие виды энергии.
Химическая термодинамика занимается изучением законов, в соответствии с которыми происходит изменение энергии системы - в ходе физико-химических процессов, определяет направление и пределы их самопроизвольного протекания.
Всякий такой процесс, в общем, является изменением состояния системы, которое можно описать с помощью функций состояния (внутренняя энергия, энтальпия, энтропия, энергия Гиббса). Термодинамические функции состояния обладают аддитивными свойствами: их величины зависят от количества вещества.
4.1 Энергетические эффекты химических реакций
Первый закон термодинамики устанавливает связь между количеством теплоты, получаемой или выделяемой в процессе, количеством работы и изменением внутренней энергии системы.
Тепловая
энергия, сообщаемая системе, расходуется
на изменение внутренней энергии системы
и на совершение системой работы против
сил, действующих извне на систему: Q
=
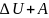
Внутренняя энергия системы U представляет собой ее полную энергию, которая складывается из энергии поступательного, вращательного, колебательного движения молекул, энергии движения электронов в молекулах и атомах, энергии связи атомов в молекулах и ядерных частиц (нуклонов в ядре), т.е. все виды энергии, кроме потенциальной и кинетической энергии системы как целого.
Абсолютную величину внутренней энергии определить невозможно, т.к. нельзя привести систему в состояние лишенное энергии. Количество внутренней энергии зависит от количества вещества, его состава и состояния.
Как функция состояния, изменение внутренней энергии не зависит от пути перехода, по которому протекает процесс перехода внутренней энергии, а определяется начальным и конечным состоянием системы:
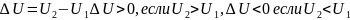
Теплота и работа функциями состояния не являются, так как служат формами передачи энергии и связаны с процессом, а не с состоянием системы.
Большинство химических процессов являются изобарно-изотермическими (p=const, t=const.).
При химических реакциях под работой против внешних сил в основном подразумевается работа против внешнего давления:
A=P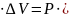 )
)
Подставим
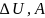 в математическое выражение для 1-го
закона термодинамики
в математическое выражение для 1-го
закона термодинамики

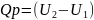 +P
+P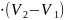

Характеристическая
функция
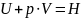 называется энтальпией
системы, тогда
называется энтальпией
системы, тогда

Энтальпия
зависит от количества вещества, поэтому
ее изменение ( Н),
обычно относят к 1 моль и выражают в
кДж/моль. Энтальпия является функцией
состояния, ее изменение (
Н)
определяется только начальным и
конечным состоянием системы и не зависит
от пути перехода. Изменение энтальпии
в химической реакции равняется изменению
внутренней энергии плюс работа расширения.
Н),
обычно относят к 1 моль и выражают в
кДж/моль. Энтальпия является функцией
состояния, ее изменение (
Н)
определяется только начальным и
конечным состоянием системы и не зависит
от пути перехода. Изменение энтальпии
в химической реакции равняется изменению
внутренней энергии плюс работа расширения.
Теплота в изобарно-изотермическом процессе Qp равна изменению энтальпии системы Н, если единственным видом работы является расширение.
Теплота
реакции в изохорно-изотермическом
процессе, поскольку изменение объема
системы не происходит,
V
= 0 и А = 0, равна изменению внутренней
энергии системы Qv
=
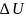
Теплоты химических процессов, протекающих при Р1Т = const, P1T = const, называются тепловыми эффектами.
Законы термохимии. Термохимические расчеты. Термохимия изучает энергетические эффекты реакции. Различают экзотермические и эндотермические реакции. При экзотермических реакциях теплота выделяется, т.е. уменьшается энтальпия или внутренняя энергия системы и значения Н и U для них отрицательны. При эндотермических реакциях теплота поглощается, т.е. энтальпия и внутренняя энергия системы возрастают, а Н и U имеют положительные значения.
Основным законом термохимии является закон Гесса: тепловой эффект реакции Нхр зависит только от природы физического состояния исходных веществ и продуктов реакции, но не зависит от пути ее протекания. Пример:
С(графит) + 02 (г) = С02 (Г) Н1 = -393,5 кДж
С(графит) + 1/202 (г) = СО (г) Н2 = -110,5 кДж
СО (r) + 1/202 (г) = С02 (г) Н3 - -283 кДж
Н1 = Н2 + Н3
На законе Гесса основаны все термохимические расчеты. Но чаще используют следствие из закона Гесса: тепловой эффект химической реакции равен сумме теплот образования Нобр продуктов реакции за вычетом суммы теплот образования исходных веществ с учетом коэффициентов перед формулами этих веществ в уравнении химической реакции:
Нхр.=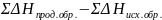
Энтальпией
(теплотой)
образования
данного
соединения
называют
тепловой эффект реакции образования 1
моля этого соединения из простых веществ,
взятых в их устойчивом состоянии при
данных условиях. Обычно теплоты
образования относят к стандартному
состоянию +25°С(298К) и 1,013 105
Па и обозначают
Н°298
[ кДж/моль].
105
Па и обозначают
Н°298
[ кДж/моль].
При разложении соединения на простые вещества происходит изменение энтальпии, равное (но с противоположным знаком) изменению энтальпии при образовании этого соединения из тех, же простых веществ.
Энтальпии (теплоты) образования простых веществ, устойчивых в стандартных условиях, принимают равными нулю. (С(графит), S(ромб.), Br(ж), I(кр.)).
Уравнения химических реакций, в которых указаны их тепловые
эффекты, называются термохимическими. При записи термохимических уравнений около символов химических соединений указывают их агрегатные состояния или кристаллические модификации, допускаются дробные коэффициенты:
Н2 (г) +1/2O2 (г) = Н20(г) Н = - 241,84 кДж.
