
Лекция 1. Предмет и задачи химии. Фундаментальные законы химии.
1.1. Основные понятия
Атомы
- это частицы, из которых построены
молекулы; они не могут
быть разложены на более мелкие части с
помощью химических реакций.
Масса атомов разных видов составляет
порядка
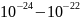 г, диаметр
атомов колеблется в пределах
г, диаметр
атомов колеблется в пределах
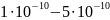 м,
поэтому атомы считаются
мельчайшими химическими частицами.
м,
поэтому атомы считаются
мельчайшими химическими частицами.
Атомы одного вида являются атомами одного химического элемента, атомы разных видов - атомами разных химических элементов. К важнейшему свойству и главному отличительному признаку атома каждого элемента относится положительный заряд его ядра.
Химический элемент - это вид атомов, характеризующийся определенной величиной положительного заряда ядра. Все химические элементы указаны в Периодической системе; каждому элементу отвечает свой порядковый номер. Значение порядкового номера элемента и значение заряда ядра атома того же элемента совпадают.
Среди чистых веществ принято различать простые и сложные вещества. Простые вещества состоят из атомов одного вида элемента. Простые вещества представляют собой формы существования элементов в свободном виде, каждому элементу соответствует, как правило, несколько простых веществ (аллотропных форм), которые могут различаться по составу, например, кислород О2 и озон О3, или по кристаллической решетке, например, алмаз и графит - для углерода.
Сложные
вещества
состоят из атомов разных элементов.
Сложные
вещества иначе называются химическими
соединениями. Пример.
Простые вещества; молекулярные кислород
О2,
хлор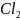 ,
натрий Na
состоят из элементов одного вида
соответственно кислорода O,
хлора Cl,
натрия Na.
Сложное вещество NaCI
состоит из элементов натрия Na
и хлора Cl.
,
натрий Na
состоят из элементов одного вида
соответственно кислорода O,
хлора Cl,
натрия Na.
Сложное вещество NaCI
состоит из элементов натрия Na
и хлора Cl.
Молекула - это наименьшая частица химического соединения, обладающая его химическими свойствами. Ионные соединения не содержат молекул.
Каждый
атом обладает определенной массой,
значение которой чрезвычайно
мало. Например, масса атома углерода
равна 1,99
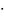 10-23
г.
10-23
г.
Абсолютная атомная масса - истинная масса атома элемента, выраженная в граммах. На практике вместо абсолютных масс атомов используются относительные атомные массы.
Относительной атомной массой элемента называют массу его шпма, выраженную в а.е.м. Она показывает, во сколько раз масса одного атома данного элемента больше одной двенадцатой части атомной массы изотопа углерода 12 (612С).
1 а.е.м. представляет собой 1/12 часть массы атома изотопа углерода 612С.
1 а,е.м, = 1,66057- 10-27кг (1,66057 10-24 г).
Значения относительных атомных масс элементов определяют как частное от деления значения абсолютной массы атома данного элемента к 1/12 части абсолютной массы атома изотопа 12С.
Пример. Масса атома фтора равна 3,15481 10-23 г, следовательно относительная атомная масса фтора равна:
А = 3,15481 10-23 г/ 1,66057 10-24 г- 18,9984 а.е.м.
В Периодической системе указаны относительные атомные массы элементов.
Относительная молекулярная масса химического соединения -это число, показывающее, во сколько раз абсолютная масса одной молекулы этого соединения больше атомной единицы массы.
Поскольку молекулы состоят из атомов, то между относительной молекулярной массой соединения и относительными атомными массами элементов есть прямая связь. Значение молекулярной массы для соединения находят суммированием относительных атомных масс элементов входящих в состав этого соединения, с учетом его химической формулы, т.е. числа атомов каждого элемента.
Относительной молекулярной массой (равной сумме атомных масс всех элементов молекулы) простого или сложного вещества называют массу его молекулы, выраженную в а.е.м.
Моль - количество вещества, содержащее столько же структурных единиц (атомов, молекул), сколько содержится атомов углерода в 12 г изотопа углерода 612С.
Число
структурных единиц, содержащихся в
одном моле любого вещества, независимо
от его агрегатного состояния, называется
числом Авогадро,
оно равно 6,022045
1023.
Физико-химическая константа отвечающая
этому числу, называется постоянная
Авогадро,
обозначается
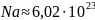 моль-1.
моль-1.
Пример. 6,02 1021 молекул СО2 составят 0,01 моль.
Чтобы соотнести между собой количество вещества и его массу введено понятие о молярной массе.
Масса одного моля данного вещества называется его мольной (молярной) массой. Единицей молярной массы в СИ является кг/моль в химической практике чаще используется г/моль.
Числовое значение молярной массы, выраженной в г/моль для одного атома простого вещества равно относительной атомной массе данного элемента, а для любого соединения - его относительной молекулярной массе. Так, молекулярная масса воды Н20 и атомная масса кислорода равны соответственно 18 а.е.м. и 16 а.е.м.; тогда их мольные (молярные) массы равны соответственно 18 г/моль и 16 г/моль.
