
- •Isbn 5-861852-282-0 © Мурманский государственный технический университет, 2006
- •© Николай Георгиевич Воронько оглавление Предисловие
- •Лабораторная работа 1 Рефрактометрия и строение молекул
- •Краткие теоретические сведения
- •Экспериментальная часть
- •Измерение и обработка результатов измерения
- •Контрольные вопросы
- •Литература
- •Лабораторная работа 2 Калориметрия. Определение интегральной теплоты растворения хорошо растворимой соли
- •Краткие теоретические сведения
- •Зависимость энтальпии реакции от температуры. Закон Киргофа
- •Значения теплоты растворения (Нраст) некоторых веществ в воде [1], [2]
- •Энтальпия гидратации ионов и солей в кДжмоль-1[1], [4]; радиусы ионов в пм
- •§5. Структурная температура и растворимость солей
- •Время ядерной спин-решеточной релаксации воды т1 при 21 с
- •§ 6. Растворимость в воде неполярных газов
- •Экспериментальная часть
- •Порядок выполнения работы
- •Контрольные вопросы
- •Литература
- •Примеры решения задач
- •Контрольные задачи
- •Cтандартные мольные энтальпии образования при 25 с (в кДж/моль)
- •Cтандартные мольные энтальпия образования и сгорания веществ при 25 с (в кДж/моль)
- •Энтальпия фазовых переходов Нm (в кДж/моль)
- •Значения энергии разрушения кристаллической решетки (Екр), энергии гидратации (Нгидр) и теплоты растворения (Нраст) некоторых солей в воде
- •Энтальпия кристаллической решетки (н) при 25 с [1], энергия гидратации (Нгидр) и теплоты растворения (Нраст) некоторых солей в воде
- •Лабораторная работа 3 Определение молярной массы растворенного вещества методом криометрии
- •Краткие теоретические сведения
- •Значения эвтектических температур водных растворов различных солей
- •Экспериментальная часть
- •Порядок выполнения работы
- •Выводы: Контрольные вопросы
- •Примеры решения задач
- •Контрольные задачи
- •Лабораторная работа 4 изучение электрической проводимости растворов электролитов
- •Краткие теоретические сведения
- •Экспериментальная часть Измерение электропроводности растворов электролитов методом компенсации
- •Измеритель rcl р5030
- •Порядок измерения сопротивления растворов электролитов на измерителе rcl р5030
- •Калибровка кондуктометрической ячейки
- •Опыт 1. Определение электрической проводимости растворов слабого электролита различной концентрации Порядок выполнения
- •Опыт 2. Определение электрической проводимости растворов сильного электролита различной концентрации Порядок выполнения
- •Контрольные вопросы
- •Контрольные задачи
- •Рекомендуемая литература
- •Использованная литература
- •Лабораторная работа 5 фотометрическое изучение кинетики разложения комплексного иона триоксалата марганца
- •Краткие теоретические сведения
- •Основные понятия и определения формальной кинетики
- •Средняя и истинная скорость реакции
- •Закон действующих масс
- •Принцип независимости протекания реакций
- •Вычисление констант скорости реакций различных порядков
- •Способы определения порядка реакции
- •Экспериментальная часть
- •1. Фотометрический метод.
- •Аппаратура и техника измерений
- •Порядок измерения оптической плотности на колориметре кфк-2
- •Порядок измерения оптической плотности на фотометре кфк-3
- •Фотометрическое изучение кинетики разложения комплексного иона триоксалата марганца
- •Порядок выполнения работы
- •Контрольные вопросы
- •Контрольные задачи
- •Рекомендуемая литература
- •Использованная литература
- •Литература
Энтальпия гидратации ионов и солей в кДжмоль-1[1], [4]; радиусы ионов в пм
Катион |
r, (10-12 м) |
|
Анион |
r, (10-12 м) |
|
Энтальпия гидратации |
|
Соль |
|
||||||
Н+ |
- |
1090 |
Cl- |
181 |
364 |
НCl |
1454 |
Li+ |
60 |
520 |
F- |
136 |
506 |
LiF |
1026 |
Na+ |
95 |
405 |
OH- |
|
460 |
LiCl |
(883884) |
K+ |
133 |
321 |
Br- |
195 |
337 |
LiBr |
(854857) |
Rb+ |
148 |
300 |
I- |
216 |
296 |
LiI |
815 |
Cs+ |
169 |
277 |
|
|
|
NaF |
911 |
Ag+ |
126 |
464 |
|
|
|
NaCl |
(769770) |
NH4+ |
|
301 |
|
|
|
NaBr |
(741742) |
Mg2+ |
65 |
1920 |
|
|
|
NaI |
701 |
Ca2+ |
88 |
1650 |
|
|
|
KF |
828 |
Sr2+ |
113 |
1480 |
|
|
|
KCl |
(685686) |
Ba2+ |
135 |
1360 |
|
|
|
KBr |
(657658) |
Fe2+ |
76 |
1950 |
|
|
|
KI |
(617619) |
Cu2+ |
|
2100 |
|
|
|
RbF |
806 |
Zn2+ |
74 |
2050 |
|
|
|
RbCl |
664 |
|
|
|
|
|
|
RbBr |
637 |
|
|
|
|
|
|
RbI |
596 |
|
|
|
|
|
|
CsF |
782 |
|
|
|
|
|
|
CsCl |
640 |
|
|
|
|
|
|
CsBr |
613 |
|
|
|
|
|
|
CsI |
572 |
Примечание. Стандартная энтальпия гидратации протона (иона водорода) при 25 С, рассчитанная термохимическим методом, равна –1090 кДжмоль1, энтальпия гидратации НCl при 25 С (табл. 2) составляет 1454 кДжмоль1. Тогда абсолютная величина энтальпии гидратации Сl(aq) равна – 364 кДжмоль1 [2].
В случае разбавленных растворов одно-, двух- и трехзарядных ионов энтальпия гидратации по модулю составляет в среднем соответственно 252; 840; 2520 кДж/моль. Предполагая, что в первой гидратной оболочке иона имеется (46) ближайших соседей, находим энтальпию гидратации по модулю (в кДж/моль) для одной молекулы воды с зарядом катиона + 1, + 2 или + 3: 6342, 210126, 630420 соответственно. Последнее значение сравнимо с энергией химической связи. Это дает основание рассматривать соответствующие гидратированные катионы как термодинамически устойчивые соединения.
В основе молекулярно-кинетического метода гидратации лежит представление о кинетической устойчивости гидратных комплексов. При этом гидратация исследуется совместно с процессом самодиффузии молекул растворителя (Самойлов О.Я). В работе [6] ближняя гидратация ионов характеризуется изменением энергии активации (Еi) процесса самодиффузии молекул воды при растворении вещества. Величина Еi = Ei – E, где Ei – энергия, которую должна иметь молекула Н2О, чтобы выйти из ближайшего окружения i-го иона; Е – энергия активации самодиффузии молекул Н2О в чистой воде.
Величина Еi связана с временем пребывания молекулы Н2О в положениях равновесия в чистой воде () и в растворе (i) выражением
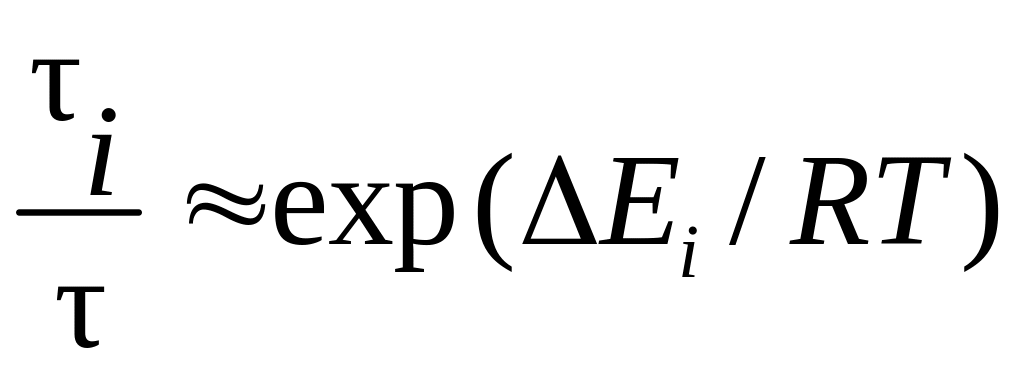 .
.
Значение Еi зависит от радиуса иона, его заряда и строения элект-ронной оболочки (табл. 3).
Таблица 3
Значения Еi и i / для некоторых ионов [6]
Параметр |
Ионы |
||||||||
Li+ |
Na+ |
K+ |
Cs+ |
Cl- |
Br- |
I- |
Мg2+ |
Ca2+ |
|
Еi, кДжмоль-1 |
2,343 |
0,586 |
1,506 |
1,297 |
0,879 |
1,632 |
1,004 |
3,347 |
1,172 |
i/ |
2,6 |
1,27 |
0,54 |
0,59 |
0,70 |
0,51 |
0,66 |
3,92 |
1,61 |
ri, пм |
68 |
98 |
133 |
165 |
181 |
196 |
220 |
74 |
104 |
Считается [6], что величина Еi может быть как положительной, так и отрицательной. Если ионы прочно связывают (Еi 0) ближайшие к ним молекулы воды, то i/ 1. Такие ионы называются положительно гидратированными (Li+, Mg2+, Ca2+, Cu2+, La2+ и др.). Молекулы воды вблизи положительно гидратированных ионов проводят больше времени, чем в положениях равновесия в чистой воде.
Если Еi 0, то i/ 1. Такая гидратация называется отрицательной (K+, Br+, Rb+, Cs+, Cl, I и др.). В этом случае обмен ближайших к ионам молекул Н2О происходит чаще, чем обмен ближайших молекул Н2О в чистой воде.
Из табл. 2 следует, что как положительные (Cu2+, Zn2+, Fe2+, Mg2+, Ca2+, Sr2+, Ba2+, Li+, F, OH и т. д), так и отрицательные ионы (Cs+, I, Rb+, NH4+, K+, Br+, Cl и т. д) существенно сильнее связаны с ближайшими молекулами воды, чем молекулы воды друг с другом в чистой воде. Это позволяет предположить, что термины "положительная" и "отрицательная" гидратация должны применяться к молекулам второй или даже третьей координационным оболочкам, т. е. эти термины отражают характер изменения взаимодействия молекул воды, входящих в гидратную оболочку i-го иона, с объемными молекулами воды или же с молекулами воды гидратных оболочек других ионов. Такая трактовка не противоречит термодинамической природе процесса гидратации.
С увеличением концентрации ионов число молекул растворителя, не входящих в ближайшее окружение ионов, уменьшается. Соответственно этому происходит перераспределение долей вклада того или иного типа взаимодействия, изменяется структура раствора и даже может измениться знак гидратации.
В связи с изучением термодинамических свойств концентрированных растворов введено понятие "границы полной сольватации", соответствующей такой концентрации, при которой число молекул растворителя отвечает сумме координационных чисел сольватации катионов и анионов. Ниже этой концентрации раствор состоит из сольватированных ионов и чистого растворителя. При концентрации, соответствующей "границе полной сольватации", в растворе свободного растворителя нет, все его молекулы входят в ближайшее окружение ионов. При дальнейшем увеличении концентрации процесс растворения прекращается и начинается выделение солей (например, КCl) или кристаллогидратов (сольватированных солей Na2SO4 ∙ 10H2O, CaCO3 ∙ 6H2O, NaCl ∙ 2H2O и т. д.).
