
- •Isbn 5-861852-282-0 © Мурманский государственный технический университет, 2006
- •© Николай Георгиевич Воронько оглавление Предисловие
- •Лабораторная работа 1 Рефрактометрия и строение молекул
- •Краткие теоретические сведения
- •Экспериментальная часть
- •Измерение и обработка результатов измерения
- •Контрольные вопросы
- •Литература
- •Лабораторная работа 2 Калориметрия. Определение интегральной теплоты растворения хорошо растворимой соли
- •Краткие теоретические сведения
- •Зависимость энтальпии реакции от температуры. Закон Киргофа
- •Значения теплоты растворения (Нраст) некоторых веществ в воде [1], [2]
- •Энтальпия гидратации ионов и солей в кДжмоль-1[1], [4]; радиусы ионов в пм
- •§5. Структурная температура и растворимость солей
- •Время ядерной спин-решеточной релаксации воды т1 при 21 с
- •§ 6. Растворимость в воде неполярных газов
- •Экспериментальная часть
- •Порядок выполнения работы
- •Контрольные вопросы
- •Литература
- •Примеры решения задач
- •Контрольные задачи
- •Cтандартные мольные энтальпии образования при 25 с (в кДж/моль)
- •Cтандартные мольные энтальпия образования и сгорания веществ при 25 с (в кДж/моль)
- •Энтальпия фазовых переходов Нm (в кДж/моль)
- •Значения энергии разрушения кристаллической решетки (Екр), энергии гидратации (Нгидр) и теплоты растворения (Нраст) некоторых солей в воде
- •Энтальпия кристаллической решетки (н) при 25 с [1], энергия гидратации (Нгидр) и теплоты растворения (Нраст) некоторых солей в воде
- •Лабораторная работа 3 Определение молярной массы растворенного вещества методом криометрии
- •Краткие теоретические сведения
- •Значения эвтектических температур водных растворов различных солей
- •Экспериментальная часть
- •Порядок выполнения работы
- •Выводы: Контрольные вопросы
- •Примеры решения задач
- •Контрольные задачи
- •Лабораторная работа 4 изучение электрической проводимости растворов электролитов
- •Краткие теоретические сведения
- •Экспериментальная часть Измерение электропроводности растворов электролитов методом компенсации
- •Измеритель rcl р5030
- •Порядок измерения сопротивления растворов электролитов на измерителе rcl р5030
- •Калибровка кондуктометрической ячейки
- •Опыт 1. Определение электрической проводимости растворов слабого электролита различной концентрации Порядок выполнения
- •Опыт 2. Определение электрической проводимости растворов сильного электролита различной концентрации Порядок выполнения
- •Контрольные вопросы
- •Контрольные задачи
- •Рекомендуемая литература
- •Использованная литература
- •Лабораторная работа 5 фотометрическое изучение кинетики разложения комплексного иона триоксалата марганца
- •Краткие теоретические сведения
- •Основные понятия и определения формальной кинетики
- •Средняя и истинная скорость реакции
- •Закон действующих масс
- •Принцип независимости протекания реакций
- •Вычисление констант скорости реакций различных порядков
- •Способы определения порядка реакции
- •Экспериментальная часть
- •1. Фотометрический метод.
- •Аппаратура и техника измерений
- •Порядок измерения оптической плотности на колориметре кфк-2
- •Порядок измерения оптической плотности на фотометре кфк-3
- •Фотометрическое изучение кинетики разложения комплексного иона триоксалата марганца
- •Порядок выполнения работы
- •Контрольные вопросы
- •Контрольные задачи
- •Рекомендуемая литература
- •Использованная литература
- •Литература
Порядок выполнения работы
1. Определение постоянной калориметра.
Для расчета теплового эффекта процесса, протекающего в калориметре, необходимо знать постоянную калориметра К – количество теплоты, требующееся для нагревания калориметрической установки на 10. Очевидно, что постоянная К представляет собой теплоемкость калориметра (К = Q / t), измеряется в Дж/моль.
Постоянную К обычно определяют непосредственным измерением количества теплоты, требующегося для изменения температуры калориметра на t . В данной работе величина К определяется по величине энтальпии растворения нитрата калия (хорошо растворимой соли), величина энтальпии растворения которого равна: m раств (KNO3) = 34 770 Дж/моль. Постоянная (К) калориметра (К=Нраст/t) связана с энтальпией растворения одного моля вещества (m раств), с навеской g и молярной масса соли (кг/моль) выражением:
m раств К t0M) / g, (14)
где молярная масса соли, кг/моль g навеска соли, кг; (g / M) – число молей растворенного вещества.
Экспериментальное определение постоянной калориметра проводят следующим образом. В фарфоровой ступке тщательно растирают 7-8 г нитрата калия. Затем соль помещают в бюкс и взвешивают вместе с воронкой с точностью до 0.01 г. В сосуд Дьюара наливают 500 мл дистиллированной воды при комнатной температуре и собирают установку в соответствии с рис. 4.
Вследствие теплообмена калориметра с окружающей средой может наблюдаться как повышение, так и понижение температуры калориметрической жидкости. Кроме того, работающая мешалка незначительно нагревает калориметрическую жидкость. Чтобы учесть эти «посторонние» эффекты и правильно определить истинное изменение температуры, вызванное лишь растворением соли, используют графический метод.
Калориметрический процесс делят на три периода: 1) предварительный (8 мин); 2) главный, соответствующий растворению соли; 3) заключительный (8 мин).
Для достижения теплового равновесия калориметра с окружающей средой на 5 мин включите тумблер "магнитная мешалка" (тумблер "нагрев" не включать!). По истечении этого времени начинайте отсчет температуры по термометру. Для увеличения разрешающей способности глаза воспользуйтесь лупой.
В течение предварительного периода (8 мин) наблюдайте за изменением температуры воды, которое может происходить лишь за счет работы магнитной мешалки и теплообмена между калориметром и окружающей средой. Температуру фиксируйте через каждую минуту. На 9-й минуте (начало главного периода), не измеряя температуры, высыпите соль из бюкса через воронку и продолжайте измерение температуры через 0.5мин, не выключая секундомера. Если температура изменяется очень быстро, отсчет можно выполнить с меньшей точностью. Главный период длится, как правило, не более 3 мин, если магнитная мешалка работает нормально.
Началом заключительного периода принято считать установление равномерного хода изменения температуры. В этом периоде температуру отмечайте так же, как и в предварительном, в течение 8 мин. Результаты измерений занесите в табл.
По окончании опыта извлеките из сосуда Дьюара цилиндрический стержень, вылейте раствор и ополосните сосуд дистиллированной водой. Взвесьте воронку и бюкс и по разности масс до и после высыпания соли найдите ее точную навеску.
По полученным данным постройте график (рис. 5) на миллиметровой бумаге, откладывая по оси абсцисс время (1 см по оси абцисс соответствует 2 мин), а по оси ординат температуру t0 (10 см соответствуют t = 10).
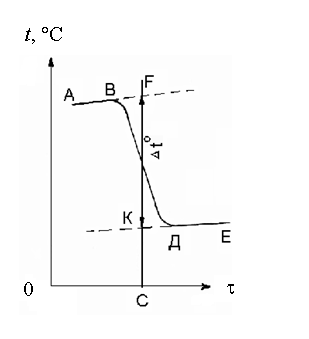
Рис. 5. Определение изменения температуры (t0) в ходе калориметрического опыта
После нанесения на график всех опытных данных, полученных при протекании эндотермического процесса, получается кривая типа АВDЕ, где АВ предварительный период, ВD главный, DЕ заключительный. Прямые АВ и DЕ экстраполируйте, время периода ВD разделите пополам (точка С). Из точки С восстановите перпендикуляр до пересечения его с экстраполированными линиями (АВF и КDЕ). Отрезок между точками К и F, выраженный в градусах, покажет истинное изменение температуры t0, вызываемое процессом, с учетом теплообмена с окружающей средой. Рассчитайте постоянную калориметра К.
Наличие температурного хода в предварительном и заключительном периодах свидетельствует о том, что во время опыта происходит теплообмен калориметра с окружающей средой.
2. Определение интегральной теплоты растворения соли.
Аналогично предыдущему опыту проведите определение t0 при растворении навески исследуемой соли. Расcчитайте m раств по формуле (14), используя значение К, полученное в первом опыте. Результаты измерений занесите в табл.
3. Обработка результатов измерений.
Таблица
Ход температуры в процессе опыта
Опыт 1 Масса вещества с бюксом и воронкой, г …. Масса бюкса и воронки, г …. Масса вещества, г …. Молярная масса ….. |
Опыт 2 Масса вещества с бюксом и воронкой, г …. Масса бюкса и воронки, г …. Масса вещества, г …. Молярная масса ….. |
||
, мин |
t, C |
, мин |
t, C |
Предварительный период |
|||
0 |
|
0 |
|
0.5 |
|
0.5 |
|
1.0 |
|
1.0 |
|
1.5 |
|
1.5 |
|
…………………………… |
|
………………………. |
|
7.5 |
|
7.5 |
|
8.0 |
|
8.0 |
|
Главный период |
|||
8.5 |
|
8.5 |
|
9.0 |
|
9.0 |
|
9.5 |
|
9.5 |
|
10.0 |
|
10.0 |
|
10.5 |
|
10.5 |
|
11.0 |
|
11.0 |
|
|
|
|
|
Заключительный период |
|||
11.5 |
|
11.5 |
|
12.0 |
|
12.0 |
|
12.5 |
|
12.5 |
|
13.0 |
|
13.0 |
|
……… |
|
……. |
|
3.1. Найдите справочное значение энтальпии растворения исследуемой соли и рассчитайте относительную погрешность измерения по формуле
,=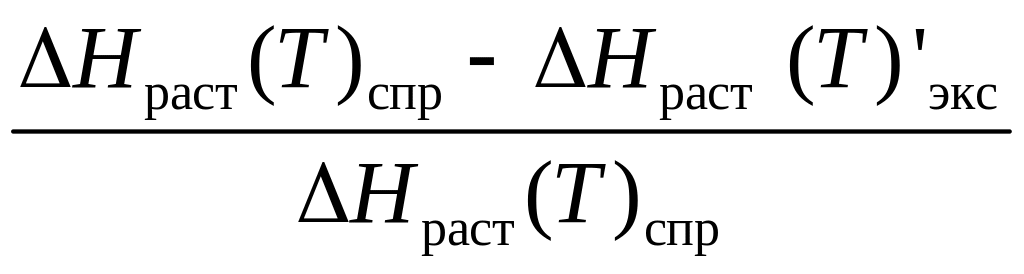 .
.
3.2. Оцените приборную погрешность определения интегральной теплоты растворения соли, считая, что основной вклад в относительную погрешность измерения вносят погрешности измерения температуры и массы навески (погрешностями определения теплоты растворения KNO3 и молярной массы пренебрегаем):
,
=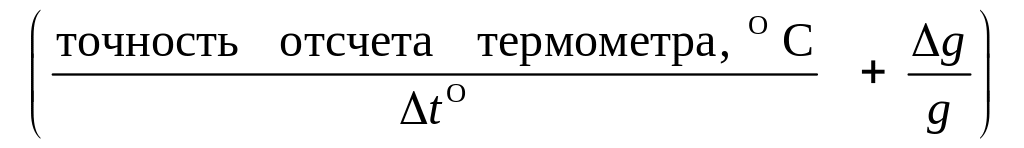 100.
100.
3.3. Сделайте выводы.
