
Лекція №2
Інструментальні методи аналізу (ІМА)
Умови виконання закону Бугера-Ламберта-Бера :
Розчин повинен бути прозорим;
Світло монохроматичне;
Промінь світла паралельне;
Світло поглинають часточки лише одного виду;
У розчині не повинно відбуватися ніяких змін впродовж вимірювання оптичної густини (гідролізу, осадження, руйнування комплексів тощо).
Для вимірювання оптичної густини одержують забарвлену речовину (фото колориметричний аналіз), найчастіше реакціями комплексоутворення:
Cu2+ [ Cu (NH3) 4]2+ (волошковий);
Co2+ [ Co (SCN) 4]2- (волошковий після екстракції аміловим спиртом);
Fe3+ [Fe (SCN) 6]3- (криваво-червоний),
рідше реакціями окиснення-відновлення:
Mn2+ MnO4 (рожево-фіолетовий);
Cr2+ Cr2O72- (жовтогарячий).
NH2
SO3H





-H2O


NO2

 HO3S
N=N-
+ H2O
HO3S
N=N-
+ H2O
NH2

Реакції одержання забарвлених сполук називають фотометричними реакціями. Ці реакції і створення умов для забезпечення стійкості забарвлених сполук складають називається хімічну частину, а друга частина – інструментальна - вибір умов оптимального світлопоглинання: довжини хвилі, при якій спостерігається максимум світлопоглинання, кювети з різною довжиною ( товщиною світло поглинаючого шару). Оптична густина приймає значення від 0 до 1,5 (2), 𝚤=0.1-5 см.
Прямі та не прямі методи фотометрії.
Визначення речовин за допомогою фотометричних реакцій можна проводити як прямими, так і опосередкованими методами.
Прямі методи – це методи , що дають змогу визначити концентрацію забарвлених сполук , зокрема органічних барвників, та безбарвних речовин, які переводять за допомогою фотометричної реакції у забарвлені сполуки і вимірюють їх поглинання: Fe3+ за pН 1,8 утворює рожево-фіолетовий комплекс із сульфосаліциловою кислотою. Цим способом користуються значно частіше; оптична густина забарвленого розчину прямо пропорційна концентрації визначуваної речовини.
Непрямі (опосередковані) методи використовують для визначення безбарвних сполук. При цьому або застосовують допоміжні забарвлені речовини, які при взаємодії з визначуваною сполукою руйнуються вміст визначуваної речовини, встановлюють за зменшенням інтенсивності світло поглинання допоміжної речовини: фторид-іони руйнують забарвлені роданідні комплекси Fе3+ і циркон-алізариновий лак:
Fe (SCN)3 + 6F- = [ Fe F 6]3- + 3SCN-;
(криваво-червоний) (безбарвний)
Циркон-алізариновий лак + 6F- = [ZrF6]2- + алізарин
(червоний) (безбарвний) (жовто-зелений)
або утворюють нову кольорову сполуку:
2СІ- + Аg2CrO4(тв.) = 2AgCI(тв.) + CrO42-
визначувана допоміжна речовина продукт реакції
речовина(безбарвна) (жовта) (жовтий)
Фотометричне титрування
Це метод титриметричного аналізу, в якому точка еквівалентності визначається фотометрично ( за зміною світло поглинання досліджуваного розчину в процесі титрування). При цьому забарвленою (фотометрично активною) речовиною може бути визначувана речовина , титрант, продукт реакції або і визначувана речовина і титрант, якщо вони поглинають світло з різною довжиною хвилі.
Fe (SCN)3 + PO43- [ Fe (PO4) 2]3- +2 SCN-; (1)
(криваво-червоний)
Cu2+ + NH4OH [ Cu ( NH3)4]2+ + 4H2O . (2).
(волошковий)
Розрахунки проводять за законом еквівалентів.
А А





т.е V (NH4OH), мл т.е V (РO3-), мл
Рис.2.1 Криві титрування : 1- фотометрично активної ( забарвленої) фотометрично неактивною ( безбарвною); 2 - навпаки
ІІ Закон світлопоглинання ( закон адитивності)
Якщо у розчині присутні декілька світлопоглинаючих речовин, які не реагують між собою і їх світлопоглинання відбувається згідно закону Бугера- Ламберта-Бера , то загальна оптична густина розчину дорівнює сумі парціальних оптичних густин компонентів:
А=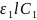 +
+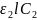 + . . .+
+ . . .+
 =
=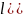 +
+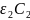 + . . .+
+ . . .+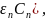 (2.1)
(2.1)
де
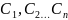 - концентрації, моль/л;
- концентрації, моль/л;
 -
молярні
коефіцієнти поглинання.
-
молярні
коефіцієнти поглинання.
Визначення концентрації кількох світло поглинаючих речовин
Їх
можна визначити, якщо
 100 нм.
100 нм.
Так, концентрацію Cr(ІІІ) і Mn(ІІ) в розчині суміші можна визначити фотометрично після їх попереднього окиснення відповідно до Cr2O72- (жовтогарячий, 𝜆мах=400нм) і МnO-4 (рожево-фіолетовий, 𝜆мах=550нм) (рис. 2.2)
А

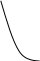

К2Сr2О7 КМnО4
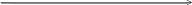
400
550
Рис. 2.2 Спектри поглинання розчинів К2Сr2О7 і КМnО4
Способи визначення концентрації світло поглинаючих речовин
1. Метод порівняння ( метод стандарту) – готують стандартний розчин з відомою концентрацією визначуваної речовини. В стандартному і досліджуваному розчині визначувану речовину переводять у світло поглинаючу сполуку. Фотометрують і отримують оптичну густину Астанд. і Ах
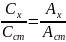 ,
,
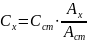 . (2.2)
. (2.2)
2. Метод обмежуючих розчинів. Готують два стандартні розчини з більшою (Ссm2) та меншою(Ссm1) концентрацією визначуваної речовини, ніж в аналізованому розчині. Метод більш точний, ніж попередній. Розчини фотометрують. Вміст визначуваної речовини обчислюють за формулою:
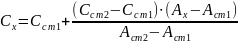 .
(2.3)
.
(2.3)
3. Метод добавок. Цей метод дає змогу врахувати вплив домішок. Готують два аналізовані розчини в один з яких добавляють відому кількість визначуваної речовини ( Сст.). Проводять фотометричну реакцію і вимірюють відповідно Ах і Аx+cm.. Розрахунок проводять за формулою:
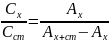 ,
,
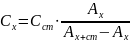 .
(2.4)
.
(2.4)
4.
Диференційна
фотометрія.
Якщо
розчин має інтенсивне забарвлення
(А≥1), тоді готують розчин порівняння з
відомою концентрацією визначуваної
речовини (Спор.).
Потім інтенсивно забарвлений розчин
фотометрують порівняно з розчином
порівняння (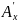 ),
а далі оптичну густину розчину порівняння
вимірюють відносно контролю ( або
холостого розчину)(Апор.).
),
а далі оптичну густину розчину порівняння
вимірюють відносно контролю ( або
холостого розчину)(Апор.).
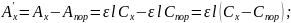 (2.5)
(2.5)
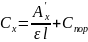 .
(2.6)
.
(2.6)
5. Метод градуювального графіка
Готують серію стандартних розчинів ( не менше трьох) з відомою концентрацією досліджуваної речовини, проводять фотометричну реакцію і вимірюють світло поглинання отриманих розчинів. Будують градюювальний графік А = f(C). За цим графіком , вимірявши в аналогічних умовах оптичну густину аналізованого розчину (Ах), знаходять вміст визначуваної речовини. Цей метод забезпечує найбільшу точність.



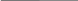

 А
А

 Ах
Ах


Сх
С1 С2 С3 С 4
Рис. 2.3. Градуювальний графік
