
- •Глава I
- •Кондуктометрическое титрование
- •Глава II
- •Определение редокс-потенциала
- •Глава III поверхностное натяжение и адсорбция
- •Изучение адсорбции пав на границе водный раствор - воздух
- •Глава IV коллоидные системы
- •Получение коллоидных растворов
- •Методы получения коллоидных систем
- •Оптические свойства дисперсных систем.
- •Строение мицеллы
- •Коллоидная защита
- •Свойства коллоидных систем
- •4. Пептизация коллоидных систем
- •Определение изоэлектрической точки белка методом набухания
- •Определение молекулярной массы полимера методом вискозиметрии
А.И. Пылинина, Т.Ф. Шешко,
Р.Е. Сафир, М.В. Шляхова
ФИЗИЧЕСКАЯ
И
КОЛЛОИДНАЯ ХИМИЯ
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ
К ЛАБОРАТОРНЫМ РАБОТАМ
Для студентов аграрного факультета
Москва
Издательство Российского университета дружбы народов
2008
Глава I
электрохимия
Лабораторная работа 1а
Определение константы диссоциации уксусной кислоты
Краткая теория:
Проводники I рода – металлы и их расплавы в которых электричество переносится электронами.
Проводники II рода – растворы и расплавы электролитов с ионным типом проводимости.
Электролиты – вещества, которые в растворе или расплаве распадаются на ионы – электрически заряженные частицы, способные к самостоятельному существованию в этих средах.
Сильные электролиты – вещества, практически полностью диссоциирующие при растворении в воде (NaCl, HCl, HNO3 и т. д.).
Слабые электролиты диссоциируют на ионы частично (органические кислоты, вода, аммиак, сероводород). Полнота диссоциации слабого электролита количественно характеризуется степенью диссоциации α – отношение числа молекул, распавшихся на ионы (Nр), к общему числу молекул этого электролита, введенных в раствор (Nо):
α =Np/No (1.1)
Степень диссоциации α выражают в долях единицы или в процентах. Степень диссоциации электролита зависит от концентрации, температуры раствора, характера растворителя, присутствия в растворе одноименных ионов.
Зависимость между степенью диссоциации α, концентрацией С и константой диссоциации КД электролита выражается законом разведения Оствальда:
![]() (1.2)
(1.2)
где Со – концентрация кислоты до диссоциации, α – степень диссоциации кислоты в растворе.
Для уксусной кислоты при температуре 250С КД = 1,85∙10-5.
Для очень слабого электролита α<<1, и тогда величиной α в знаменателе можно пренебречь (закон разбавления Оствальда):
КД
≈ Со
α2
или
![]() (1.3)
(1.3)
Электрический ток есть упорядоченное перемещение заряженных частиц.
Всякий проводник, по которому течет ток, представляет для него определенное сопротивление R, которое, согласно закону Ома, прямо пропорционально длине проводника l и обратно пропорционально площади сечения S; коэффициентом пропорциональности является удельное сопротивление материала ρ – сопротивление проводника, имеющего длину 1 см и сечение 1 см2:
![]() (1.4)
(1.4)
где ρ – удельное сопротивление, (Ом∙м).
Величина W, обратная сопротивлению, называется электропроводностью – количественной меры способности раствора электролита проводить электрический ток и зависит от геометрических параметров проводника:
![]() (1.5)
(1.5)
где æ – удельная электропроводность, количественная характеристика способности проводников проводить электрический ток (Ом-1∙см-1) или (См∙м-1) (См – сименс). При l = 1 см и S = 1 см2 æ = W. Физический смысл удельной электропроводности – это электропроводность проводника длиной 1 см с площадью поперечного сечения 1 см2.
Зависимости удельной электропроводности от концентрации водных растворов некоторых электролитов представлены на рис.1.
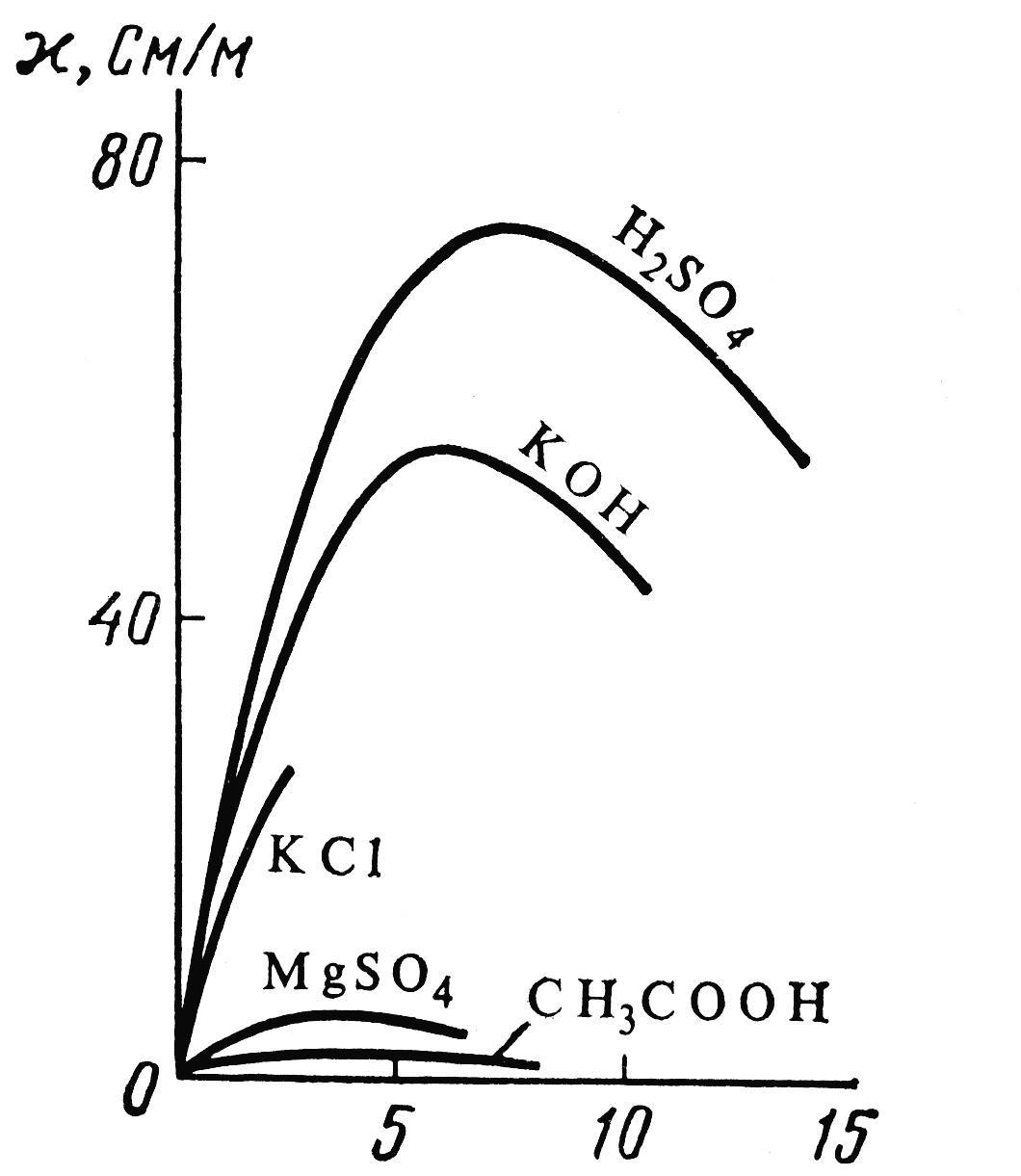
Рис.1. Зависимости удельной электропроводности
от концентрации водных растворов некоторых электролитов.
При c0 величина æ стремится к удельной электропроводности чистой воды, которая составляет приблизительно 10‑5 См/м и обусловлена присутствием ионов Н3О+ и ОН-, возникающих при частичной диссоциации воды. С ростом концентрации электролита удельная электропроводность æ сначала увеличивается, что объясняется увеличением числа ионов (носителей заряда) в растворе. Однако, чем больше ионов в растворе, тем сильнее проявляется ион-ионное взаимодействие, приводящее к замедлению движения ионов, а также к их ассоциации. Поэтому почти всегда зависимость удельной электропроводности от концентрации электролита проходит через максимум.
Мольная электропроводность (эквивалентная электропроводность) λ – это электропроводность объема раствора, содержащего 1 моль (или 1 грамм-эквивалент) растворенного вещества и заключенного между электродами, находящимися на расстоянии 1см. В реальных системах мольная электропроводность всегда зависит от концентрации (рис.2).
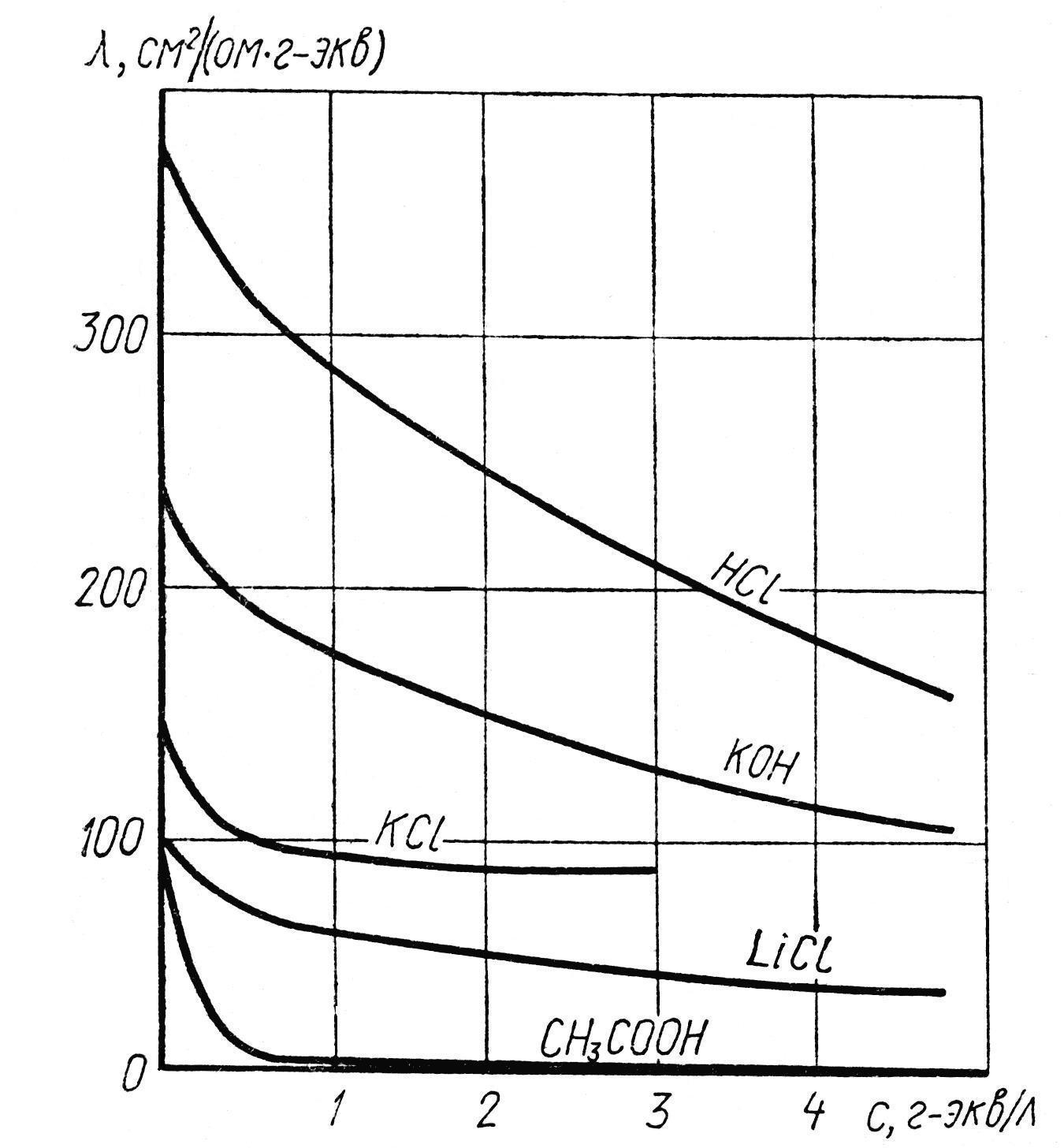
Рис.2. Зависимости эквивалентной электропроводности от концентрации водных растворов некоторых электролитов.
Размерность λ – (Ом-1∙см2∙моль-1) или (Ом-1∙см2∙г-экв-1).
λ = æ∙υ (1.6)
где υ – разведение раствора, величина обратная концентрации,
(см3 ∙моль-1):
υ =1000/C (1.7)

Рис.3. Зависимость эквивалентной электропроводности
раствора KCl от разбавления.
При с0 (или v) величина стремится к своему предельному значению о, отвечающему отсутствию ион-ионных взаимодействий. Для иллюстрации этого часто используют графическое представление в координатах =f(1/c) (рис.3) В растворах слабых электролитов, где ион-ионные взаимодействия приводят к образованию нейтральных молекул уже при очень низких концентрациях ионов, выход на предел экспериментально наблюдать не удается.
Разведение, при котором достигается максимальное значение молярной электропроводности, условно называется бесконечным, а соответствующая ему электропроводность λ∞ называется молярной электропроводностью при бесконечном разведении. Величину λ∞ рассчитывают по значениям λ∞ для сильных электролитов, содержащих соответствующие ионы:
λ∞(CH3COOH) = λ∞(CH3COONa) + λ∞(HCl) - λ∞(NaCl) (1.8)
Электропроводность электролита складывается из электропроводности катиона и аниона. Поэтому можно рассматривать λ∞, как свойство суммарное (аддитивное):
λ∞ = λ+ + λ- (1.9)
Уравнение (1.9) является выражением закона Кольрауша: мольная электропроводность раствора электролита при бесконечном разведении равна сумме подвижностей ионов:
λ+ = Fu+ – подвижность катиона, (м2 ∙Ом-1 ∙моль-1);
λ- = Fu- – подвижность аниона, (м2 ∙Ом-1 ∙моль-1);
F – число Фарадея 96487 (Кл/моль),
u+ и u- – абсолютные подвижности катиона и аниона, (м2∙В-1∙с-1).
Зная значения молярной электропроводности при данном и при бесконечном разведениях можно вычислить степень диссоциации по формуле Аррениуса:
α = λ/λ∞ (1.10)
Цель работы: С помощью измерения удельной электропроводности растворов уксусной кислоты в интервале концентраций 0,0125 М 0,1 М, рассчитать мольную электропроводность, степень и константу диссоциации уксусной кислоты. Сделать заключение о применимости законов, справедливых для разбавленных растворов, для описания свойств раствора изученного слабого электролита уксусной кислоты.
Оборудование: Портативный измеритель электропроводности и температуры для стандартных измерений, мерные цилиндры и стаканы для растворов уксусной кислоты и дистиллированной воды.
Реактивы: 0,1 M СН3СООН, дистиллированная вода.
Порядок работы:
Измерить температуру воздуха в лаборатории и записать в тетрадь.
Промыть электрод с ячейкой дистиллированной водой и раствором уксусной кислоты концентрации 0,1 моль л–1.
С помощью мерного цилиндра налить в стакан 50 мл раствора уксусной кислоты концентрации 0,1 моль л–1.
Опустить электрод с ячейкой в стакан с уксусной кислотой и измерить удельную электропроводность раствора.
Отлить из стакана 25 мл раствора кислоты и добавить в стакан 25 мл дистиллированной воды (получили раствор с концентрацией 0,05 моль/л). Тщательно перемешать раствор, измерить его удельную электропроводность.
Отлить из стакана 25 мл раствора, добавить 25 мл дистиллированной воды (получили раствор с концентрацией 0,025 мольл-1). Вновь измерить удельную электропроводность раствора.
Отлить из стакана 25 мл раствора, добавить 25 мл дистиллированной воды (получили раствор с концентрацией 0,0125 мольл-1). Вновь измерить удельную электропроводность раствора
Таблица 1.
t = °С
C моль л1 |
V см3 моль1 |
æ Ом1 см1 |
Ом1 см2 моль1 |
|
К |
__ К |
0,1 |
|
|
|
|
|
|
0,05 |
|
|
|
|
|
|
0,025 |
|
|
|
|
|
|
0,0125 |
|
|
|
|
|
Результаты измерений и расчетов записать в рабочую тетрадь.
Рассчитать значения разведения, молной электропроводности, степени и константы диссоциации по формулам, приведенным в рабочей тетради.
Величину рассчитать, используя подвижности анионов и катионов при измеренной температуре. (Приложение 5).
Результаты работы представить в виде графиков зависимостей:
а) удельной электропроводности от разведения æ = f (С);
б) мольной электропроводности от разведения = f (V);
в) степени диссоциации от разведения = f (V).
Вопросы к работе 1
Привести примеры проводников первого и второго рода. Причина диссоциации электролитов на ионы в дипольном растворителе. Что является носителем заряда в этих проводниках?
Понятия: электропроводность, удельная электропроводность, молярная электропроводность. Дайте размерности этих величин.
Как изменяется степень диссоциации слабого электролита с ростом концентрации его раствора?
От каких факторов зависит электропроводность растворов электролитов?
Объяснить причины изменения удельной электропроводности растворов сильных и слабых электролитов при изменении их концентрации.
Объяснить причины изменения мольной электропроводности растворов сильных и слабых электролитов при изменении их концентрации.
Сформулировать закон Кольрауша о независимой подвижности ионов. Записать математическое выражение этого закона и указать его практическое значение.
Сформулируйте закон разведения Оствальда и запишите математическое выражение этого закона.
В чем заключается физический смысл разведения?
Что называется степенью диссоциации? Какие факторы влияют на степень диссоциации?
Что называется константой диссоциации? Написать выражения для констант диссоциации для НCOOH, H2CO3 по первой и второй ступеням.
Задачи к работе 1
Какая взаимосвязь существует между степенью и константой диссоциации слабых электролитов?
Каково соотношение между абсолютной скоростью движения ионов и подвижностью?
Рассчитать мольную электропроводность CH3COOK при бесконечном разведении, если подвижности ионов CH3COO и К+ равны 40,9 Ом1 см2 моль1 и 75,3 Ом1 см2 моль1, соответственно.
Вычислить предельную молярную электрическую проводимость CaCl2 при 25°С, если подвижности ионов Ca+2 и Cl- соответственно равны 119 Ом1 см2 моль1 и 76,3 Ом1 см2 моль1.
Рассчитать концентрацию раствора электролита, если его разведение 50000 см3 моль1.
Показать расчетом, какой из растворов электролитов KOH, KBr, HBr одинаковой концентрации имеет наибольшую мольную электропроводность.
Рассчитать степень диссоциации раствора муравьиной кислоты концентрации 0,05 М, если константа ее диссоциации равна 1,8104. Считать, что степень диссоциации много меньше единицы.
Степень диссоциации муравьиной кислоты равна 0,3. Рассчитать мольную электропроводность муравьиной кислоты, если подвижности ионов НСОО и Н+ равны 56,4 Ом1 см2 моль1и 350 Ом1 см2 моль1, соответственно.
Абсолютные скорости движения ионов К+ и ОН при 298 К равны 7,62104 см2 В1 с1 и 20,5 104 см2 В1 с1, соответственно. Рассчитать мольную электропроводность гидроксида калия при бесконечном разведении.
Рассчитать удельную электрическую проводимость в 0,001 М растворе HCl, если абсолютные скорости H+ и Cl- равны 32,4104 см2 В1 с1 и 6,8104 см2 В1 с1.
Молярная электрическая проводимость 0,1 М раствора AgNO3 равна 94,3 См см2/моль. Определите удельную электрическую проводимость этого же раствора, если расстояние между электродами равно 3 см и поверхность каждого электрода 7 см2.
Для предельно разбавленных растворов KBr, K2SO4 и Li2SO4 молярная электрическая проводимость соответственно равна 151,6; 307,7; 237,2 См см2/моль. Вычислите молярную электрическую проводимость для предельно разбавленного раствора LiBr.
Эквивалентная электропроводность бесконечно разбавленных растворов KCl, KNO3, и AgNO3 при 25°С равна, соответственно, 149,9, 145,0 и 133,4 См см2/моль. Какова эквивалентная электропроводность бесконечно разбавленного раствора AgCl при 25°С?
Рассчитайте удельную электрическую проводимость 0,16 М раствора пропионовой кислоты при 298 К, если Кд(С2Н5СООН)=1,3410-5.
Вычислите предельную молярную электрическую проводимость бензойной кислоты, если предельная молярная электрическая проводимость электролитов NaBr, HBr, и C6H5COONa соответственно равны: 128,5 Ом1 см2 моль1, 428,2 Ом1 см2 моль1 и 82,5 Ом1 см2 моль1.
Молярная электрическая проводимость раствора муравьиной кислоты при 25°С и разведении 1024 л/моль равна 143,5 Ом1 см2 моль1, а при бесконечном разведении – 406,5 Ом1 см2 моль1. Определите константу диссоциации кислоты.
Вычислите степень и константу диссоциации масляной кислоты, если удельная электрическая проводимость раствора масляной кислоты с концентрацией 0,0156 моль/л равна 1,8110-4 Ом-1см-1.
Вычислите молярную электрическую проводимость хлорида бария в 10%-ном водном растворе (плотность 1,092 г/мл). Удельная электрическая проводимость этого раствора равна 0,0073 Ом-1см-1.
Удельная электрическая проводимость раствора, в 1,5 л которого находится 4,43 г хлоруксусной кислоты, равна 2,4110-3 См/см. Определите степень и константу диссоциации хлоруксусной кислоты в данном растворе.
Водный раствор, содержащий массовую долю CaCl2, равную 5%, имеет при 298 К плотность ρ=1,039 г/см3 и удельную электрическую проводимость 6,4310-2 См/см. Определите молярную электрическую проводимость.
Молярная электрическая проводимость раствора с массовой долей 38% H2SO4 равна 140 Ом1 см2 моль1 при 293 К. Определить удельную электрическую проводимость указанного раствора, если его плотность 1,286 г/см.
При 295 К удельная электрическая проводимость раствора, содержащего 10% SrCl2, равна 8,8610-2 См/см, а плотность раствора равна 1,0925 г/см3. Определите молярную электрическую проводимость данного раствора.
Удельная электропроводность 5%-го раствора Mg(NO3)2 при 18°С равна 4,38 См/м, а его плотность – 1,038 г/см3. Рассчитайте эквивалентную электропроводность раствора и кажущуюся степень диссоциации соли в растворе. Подвижности ионов Mg+2 и NO3- при 18°С равна 44,6 и 62,6 Ом1 см2 моль1.
Удельная электропроводность 4%-го водного раствора H2SO4 при 18°С равна 0,168 См/см, а плотность раствора – 1,026 г/см3. Рассчитайте эквивалентную электропроводность раствора.
Эквивалентная электропроводность водного раствора сильного электролита при 25°С равна 109,9 См см2 моль1 при концентрации 6,210-3 моль/л и 106,1 См см2 моль1 при концентрации 1,510-2 моль/л. Какова эквивалентная электропроводность раствора при бесконечном разбавлении?
Эквивалентная электропроводность водного раствора слабой одноосновной кислоты при 25°С равна 16,0 См см2 моль1 при концентрации 1,010-2 моль/л и 48,4 См см2 моль1 при концентрации 1,010-3 моль/л. Рассчитайте эквивалентную электропроводность раствора при бесконечном разбавлении и константу диссоциации кислоты.
Константа диссоциации гидроксида аммония равна 1,7910-5. Рассчитайте концентрацию NH4OH, при которой степень диссоциации равна 0,01, и эквивалентную электропроводность раствора при этой концентрации.
Константа диссоциации масляной кислоты C3H7COOH равна 1,7410-5. Эквивалентная электропроводность раствора при разведении 1024 л/моль равна 41,3 См см2 моль1. Рассчитайте степень диссоциации кислоты и концентрацию ионов водорода в этом растворе, а также эквивалентную электропроводность раствора при бесконечном разведении.
Эквивалентная электропроводность раствора гидроксида этиламмония C2H5NH3OH при бесконечном разведении равна 232,6 См см2 моль1. Рассчитайте константу диссоциации гидроксида этиламмония раствора, степень диссоциации и концентрацию ионов гидроксила в растворе при разведении 16 л/моль, если удельная электропроводность раствора при данном разведении равна 1,31210-5 См см-1.
Лабораторная работа 1б
